题目内容
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
【答案】 丙酸钠 取代反应 羟基、羧基 NaOH水溶液 加热 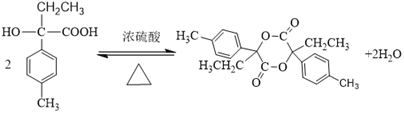
![]() 20
20 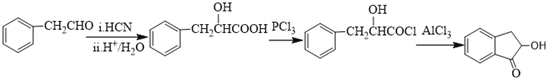
【解析】根据物质C氧化为D,D又被氢氧化铜悬浊液氧化可知,C为饱和一元醇,且羟基一定在碳链的端位,才能被氧化为醛,氧化为羧酸;所以C为1-丙醇,D为丙醛,E为丙酸钠;以此类推,A为丙烯,B为1-溴丙烷;F为丙酸,根据物质G结构看出,F变化到G为取代反应,生成丙酰氯,然后结合题给信息可知:丙酰氯与甲苯在氯化铝作催化剂的条件下,发生对位取代反应生成有机物H。
(1)根据上述分析可知E为丙酸钠;由G生成H的反应类型为取代反应;正确答案:丙酸;取代反应。
(2)根据题给信息,有机物H中的羰基与氢氰酸发生了加成反应,生成了羟基,再在酸性条件下-CN发生水解生成了-COOH,所以有机物I中官能团名称:羟基、羧基;B→C的反应是由溴代烃变为醇,需要的条件为NaOH水溶液并加热 ;正确答案: 羟基、羧基;NaOH水溶液、加热。
(3)2个有机物I可以相互酯化生成二元酯,I合成K的化学方程式的正确答案为: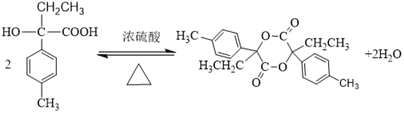 ;
;
(4)丙醛在碱性环境下被氢氧化铜的悬浊液加热后氧化为羧酸盐,本身还原为氧化亚铜;反应的方程式为:![]() ;正确答案:
;正确答案:
![]() 。
。
(5)①与FeCl3溶液发生显色反应,一定属于酚类,有机物I中含有羧基和羟基,所以该有机物一定含有酚羟基和羧基;苯环上有3个取代基除苯环外,还有三个碳,一个被羧基占用,另外两个可以为乙基,这样的结构有10种;或者是一个甲基和一个-CH2-COOH和一个-0H,这样的结构有10种,共有20种;正确答案:20。
(6)由![]() 与氢氰酸发生加成反应并在酸性条件下水解生成羟基羧酸,然后在三氯化磷的作用下,发生取代反应变为酰氯,然后在氯化铝的作用下,发生取代反应生成
与氢氰酸发生加成反应并在酸性条件下水解生成羟基羧酸,然后在三氯化磷的作用下,发生取代反应变为酰氯,然后在氯化铝的作用下,发生取代反应生成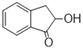 ;流程如下:
;流程如下:
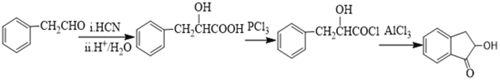 ;正确答案:
;正确答案: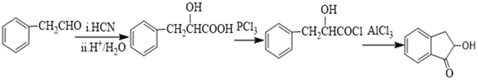 。
。

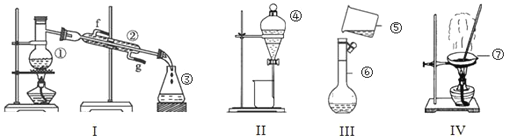
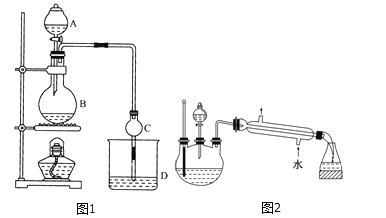
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
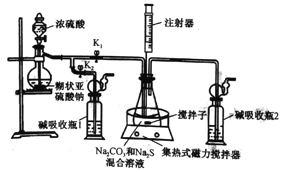
(1)浓硫酸的作用是__________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是__________。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出__________;再加入无水硫酸钠除去水,然后进行__________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)__________。