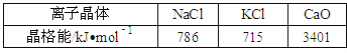题目内容
【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。
【答案】0.042mol·L-1·min-1 9/16 > 60%
【解析】
根据反应速率等于单位时间的浓度该变量进行计算。根据平衡常数的公式计算。根据温度对反应速率和平衡的影响分析温度高低。
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)= ![]() =0.042mol·L-1·min-1,该条件下的平衡常数K=
=0.042mol·L-1·min-1,该条件下的平衡常数K=![]() = 9/16。
= 9/16。
(3)改变温度,平衡正向移动,因为该反应正向为放热反应,说明改变条件为降温。
(4). C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始浓度1.20 1.40 1.40
改变浓度 2x x x
平衡浓度 1.20-2x 1.40+x 1.40+x
T2是平衡常数为![]() =4,加入混合物后Qc=
=4,加入混合物后Qc=![]() <K,则此时反应正向移动,有
<K,则此时反应正向移动,有![]() =4,x=0.2,计算一氧化氮起始总物质的量为2+2=4mol,平衡时的物质的量为(1.2-2×0.2)×2=1.6mol,则一氧化氮的消耗的物质的量为4-1.6=2.4mol,二氧化氮的转化率为2.4/4=60%。
=4,x=0.2,计算一氧化氮起始总物质的量为2+2=4mol,平衡时的物质的量为(1.2-2×0.2)×2=1.6mol,则一氧化氮的消耗的物质的量为4-1.6=2.4mol,二氧化氮的转化率为2.4/4=60%。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案