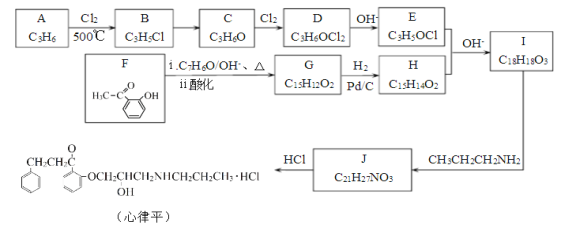
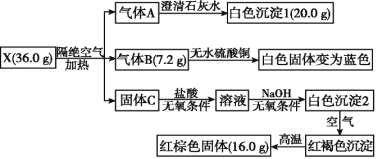
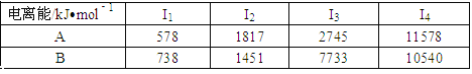
题目内容
【题目】了解并理解物质的内部结构以及化学键和晶体类型可以帮助我们更好地了解物质世界。已知:实验室用![]() 制氯化氢,溶于水形成盐酸。
制氯化氢,溶于水形成盐酸。
(1)写出原子的结构示意图Na_______,Cl______。
(2)NaCl电子式为___,所含化学键名称_____,属于______晶体;HCl电子式为____,所含化学键名称____,属于______晶体。
(3)氯化氢溶于水形成盐酸的电离方程式______。
【答案】![]()

![]() 离子键 离子
离子键 离子 ![]() 极性共价键 分子 HCl=H++Cl-
极性共价键 分子 HCl=H++Cl-
【解析】
(1)Na原子的核电荷数为11,核外有11个电子,原子的结构示意图:![]() ;Cl原子核电荷数为17,核外电子数为17,原子的结构示意图:
;Cl原子核电荷数为17,核外电子数为17,原子的结构示意图: ;
;
故答案是:![]() ;
; ;
;
(2)NaCl属于离子化合物,电子式为![]() ;含有离子键,属于离子晶体;HCl属于共价化合物,电子式为
;含有离子键,属于离子晶体;HCl属于共价化合物,电子式为![]() ;含有极性共价键,属于分子晶体;
;含有极性共价键,属于分子晶体;
故答案是:![]() ;离子键;离子;
;离子键;离子;![]() ;极性共价键;分子;
;极性共价键;分子;
(3)氯化氢属于强电解质,溶于水后能够完全电离出氢离子和氯离子,电离方程式为:HCl=H++Cl-;
故答案是:HCl=H++Cl-。

练习册系列答案
相关题目
【题目】已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 8.1 | 11.6 | 9.7 | 8.4 |
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF