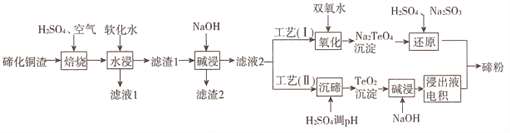
��Ŀ����
����Ŀ����ѡ��3:���ʽṹ�����ʡ�ͭԪ�ؿ��γɶ�����Ҫ������ش���������:
(1)ͭԪ��λ��Ԫ�����ڱ��е�_____��,���̬ԭ�ӵļ۵����Ų�ͼΪ_________��
(2)������ͭ��Һ�м��������ˮ,���γ�[Cu(NH3)4]SO4��Һ,����Һ�������ܽ���ά�ء�
��[Cu(NH3)4]SO4�������ӵ����幹����__________��
����[Cu(NH3)4]SO4��,Cu2+��NH3֮���γɵĻ�ѧ����Ϊ______���ṩ�µ��ӶԵijɼ�ԭ����_________��
�۳���Ԫ���⣬[Cu(NH3)4]SO4������Ԫ�صĵ縺����С�����˳��Ϊ________��
��NF3��NH3�Ŀռ乹����ͬ������ԭ�ӵĹ���ӻ����;�Ϊ_________����NF3������Cu2+�γɻ�ѧ������ԭ����_______________��
(3)һ��Hg-Ba-Cu-O���³������ϵľ���(������)��ͼ��ʾ��

�ٸ����ʵĻ�ѧʽΪ__________��
����֪�þ���������Ba2+�ļ��Ϊcpm.�����Ba2+�����Hg+��ĿΪ_____�������ߵ���̾���Ϊ_______pm��(�г�����ʽ���ɣ���ͬ)
��������ʵ�Ħ������ΪM,�����ӵ�������ֵΪNA����þ�����ܶ�Ϊ______g��cm-3��
���𰸡� ds ![]() �������� ��λ�� N Cu<H<N<O sp3 F�ĵ縺�Ա�N��,N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ,�����γ���λ������NF3������Cu2+�γ������� HgBa2CuO4 4
�������� ��λ�� N Cu<H<N<O sp3 F�ĵ縺�Ա�N��,N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ,�����γ���λ������NF3������Cu2+�γ������� HgBa2CuO4 4 ![]()
![]()
����������1��Cu��29��Ԫ�أ�ԭ�Ӻ��������Ϊ29��λ��Ԫ�����ڱ��е�ds����Cu��̬ԭ�Ӻ�������Ų�ʽΪ��1s22s22p63s23p63d104s1���۵����Ų�ʽΪ��3d104s1���۵����Ų�ͼΪ��![]() ��
��
�ʴ�Ϊ��ds��![]() ��
��
��2����SO42-��Sԭ�ӵŶԵ��Ӷ���=![]() ���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������塣
���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������塣
�ʴ�Ϊ������������
��Ni2+�ṩ�չ����NH3��Nԭ�Ӻ��йµ��Ӷԣ�����֮���γ���λ����
�ʴ�Ϊ����λ����N��
�۷ǽ�����Խǿ���縺��Խ��ͬ��������Ԫ�ش������ҵ縺����ǿ���ʵ縺��H��N��O��CuΪ����Ԫ�أ��������ӵ������dz������ʵ縺���������ʵ縺�Դ�С˳��Ϊ��Cu<H<N<O��
�ʴ�Ϊ��Cu<H<N<O��
��NH3��Nԭ���ӻ������Ϊ��5+3����2=4����ȡsp3�ӻ���ʽ��F�ĵ縺�Ա�N��,N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ,�����γ���λ������NF3������Cu2+�γ���������
�ʴ�Ϊ��sp3��F�ĵ縺�Ա�N��,N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ,�����γ���λ������NF3������Cu2+�γ���������
��3���ٸþ�����Baԭ�Ӹ���=2��Hgԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=4��
=1��Cuԭ�Ӹ���=4��![]() =1��Oԭ�ӵĸ���=8��
=1��Oԭ�ӵĸ���=8��![]() +4��
+4��![]() =4���ʻ�ѧʽΪHgBa2CuO4��
=4���ʻ�ѧʽΪHgBa2CuO4��
�ʴ�Ϊ��HgBa2CuO4��
�ڸ��ݾ����ṹͼ֪���������Ba2+Ϊ������Χ��������ҵȾ���ķֲ����µ����4�������ϣ����Ծ���Ba2+�����Hg+��ĿΪ4����Ba2+���µ������ĵľ���Ϊ![]() pm����Ba2+��Hg+����̾���Ϊx������x2=(
pm����Ba2+��Hg+����̾���Ϊx������x2=(![]() )2+��
)2+��![]() ��2�����x=
��2�����x=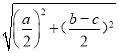 pm.
pm.
�ʴ�Ϊ�� 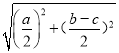 ��
��
�۸þ���������= ![]() �����=a2b pm3= a2b (10-10cm)3= a2b��10-30cm3�����Ըþ�����ܶ�=
�����=a2b pm3= a2b (10-10cm)3= a2b��10-30cm3�����Ըþ�����ܶ�=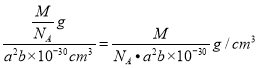 ��
��
�ʴ�Ϊ�� ![]() ��
��