题目内容
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
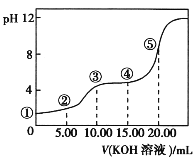
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
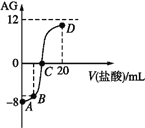
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
【答案】-244.1 < bc 0.025 mol·L-1·min-1 4/45(或0.089) A 催化剂活性随温度升高而增大,使NOx去除反应速率迅速增大;温度升高,反应速率加快 催化剂活性下降(或NH3与O2反应生成了NO)
【解析】
(1)根据盖斯定律计算△H;
(2)①可逆反应升高温度平衡向吸热反应方向移动;
②为提高反应速率同时提高NO的转化率,需要改变条件平衡正向进行;
③在密闭容器中充入10molCO和8molNO,发生反应,压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,NO体积分数为25%,结合三行计算列式计算,v(N2)=△c/△t,该温度下平衡常数Kp=生成物平衡分压幂次方乘积/反应物平衡分压幂次方乘积;
④若在D点升温的同时扩大体积至体系压强减小,则平衡会正向移动,NO的体积分数增大;
(3)①在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低;
②在温度、催化剂条件下,氨气能被催化氧化生成NO。
(1)已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
由盖斯定律可知,②-①2-③2得2N2O(g)=2N2(g)+O2(g),则△H=-114.14 kJmol-1 -(+180.5kJ·mol-1)2-(-115.52kJmol-1)2=-244.1kJ·mol-1,则反应2N2O (g)=2N2(g)+O2(g) △H=-244.1kJmol-1;
(2)①已知T2>T1,由图示可知反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),升高温度后,平衡后NO的体积分数增大,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,则△H<0;
2N2(g)+2CO2(g),升高温度后,平衡后NO的体积分数增大,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,则△H<0;
②2CO(g)+2NO(g)![]() N2(g+2CO2(g)△H<0;
N2(g+2CO2(g)△H<0;
a.改用高效催化剂加快反应速率,平衡不变,转化率不变,故a不能同时提高反应速率和NO的转化率;
b.缩小容器的体积,体系内压强增大,反应速率增大,平衡正向进行,NO的转化率增大,故b能同时提高反应速率和NO的转化率;
c.增加CO的浓度反应速率增大,平衡正向进行,NO的转化率增大,故c能同时提高反应速率和NO的转化率;
d.升高温度反应速率增大,反应为放热反应,升温平衡逆向进行,NO的转化率减小,故d不能同时提高反应速率和NO的转化率;故选bc;
③在密闭容器中充入10molCO和8molNO,发生反应,压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,NO体积分数为25%,结合三行计算列式计算,设反应生成氮气物质的量为x,
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-749 kJ·mol-1;
N2(g)+2CO2(g)△H=-749 kJ·mol-1;
起始量(mol) 10 8 0 0
变化量(mol) 2x 2x x 2x
平衡量(mol) 10-2x 8-2x x 2x
(8-2x)/(10-2x+8-2x+x+2x)×100%=25%,x=2mol,v(N2)=△c/△t=2mol/(4L×20min)=0.025 mol·L-1·min-1;
平衡气体总物质的量=16mol,该温度下平衡常数Kp=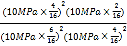 =0.089(MPa)-1;
=0.089(MPa)-1;
④若在D点升温的同时扩大体积至体系压强减小,则平衡会逆向移动,NO的体积分数增大,重新达到的平衡状态可能是图中A点;
(3)在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低,根据图知:
①催化剂活性随温度升高而增大,使NOx去除反应速率迅速增大;温度升高,反应速率加快.
②在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性下降;(或在温度、催化剂条件下,氨气能被催化氧化生成NO),
即:当反应温度高于380℃时,NOx的去除率迅速下降的原因可能催化剂活性下降(或NH3与O2反应生成了NO)。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。