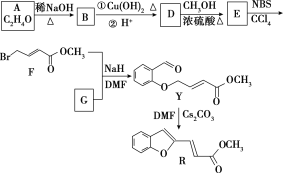
题目内容
【题目】下列有关说法正确的是( )
A.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
B.吸热反应TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)一定条件下可自发进行,则该反应ΔS<0
C.实验室制氢气,为了加快反应速率,可向稀 H2SO4中滴加少量 Cu(NO3)2溶液
D.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
【答案】A
【解析】
A、不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,可知发生沉淀的转化,则证明AgCl能转化为溶解度更小的Ag2S,所以溶液后 c(Ag+) 更小了,故A正确;
B、反应前后气体的总量不变△S=0,故B错误;
C、硝酸具有强氧化性,与活泼金属反应生成氮的氧化物,可改为滴加少量的硫酸铜溶液,形成微小原电池加快反应速率,故C错误;
D、正反应是放热反应,升高温度,平衡逆向移动,平衡时氢气转化率减小,故D错误;
故选A。

【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。
【题目】贮氢合金![]() 可催化由CO、
可催化由CO、![]() 合成
合成![]() 等有机化工产品的反应。温度为TK时发生以下反应:
等有机化工产品的反应。温度为TK时发生以下反应:
①![]()
![]()
②![]()
![]()
③![]()
④![]()
(1)温度为TK时,催化由CO、![]() 合成
合成![]() 反应的热化学方程式为________。
反应的热化学方程式为________。
(2)已知温度为TK时![]() 的活化能为
的活化能为![]() ,则其逆反应的活化能为________
,则其逆反应的活化能为________![]() 。
。
(3)![]() 时,向一恒压密闭容器中充入等物质的量的
时,向一恒压密闭容器中充入等物质的量的![]() 和
和![]() 发生上述反应②
发生上述反应②![]() 已排除其他反应干扰
已排除其他反应干扰![]() ,测得
,测得![]() 物质的量分数随时间变化如下表所示:
物质的量分数随时间变化如下表所示:
时间 | 0 | 2 | 5 | 6 | 9 | 10 |
|
|
|
|
|
|
|
若初始投入CO为![]() ,恒压容器容积
,恒压容器容积![]() ,用
,用![]() 表示该反应
表示该反应![]() 分钟内的速率
分钟内的速率![]() ________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
(4)![]() 下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为
下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为![]() ,达到平衡转化率为
,达到平衡转化率为![]() ,则反应的平衡常数
,则反应的平衡常数![]() ________
________![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数,忽略其它反应
物质的量分数,忽略其它反应![]() 。
。
(5)某温度下,将![]() 与
与![]() 的混合气体充入容积为
的混合气体充入容积为![]() 的密闭容器中,在催化剂的作用下发生反应③。经过
的密闭容器中,在催化剂的作用下发生反应③。经过![]() 后,反应达到平衡,此时转移电子
后,反应达到平衡,此时转移电子![]() 。若保持体积不变,再充入
。若保持体积不变,再充入![]() 和
和![]() ,此时
,此时![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。下列不能说明该反应已达到平衡状态的是________。
。下列不能说明该反应已达到平衡状态的是________。
![]() 的质量不变
的质量不变 ![]() 混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
![]()
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
(6)已知![]() 、
、![]() 时水煤气变换中CO和
时水煤气变换中CO和![]() 分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的
分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等;已知
相等;已知![]() 时
时![]() 的
的![]() 。
。

![]() 时
时![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时
时![]() 随时间变化关系的曲线是________。
随时间变化关系的曲线是________。