题目内容
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
【答案】D
【解析】
A.电解饱和食盐水生成NaOH、H2和Cl2,则(1)中黑色固体变红发生的反应为CuO+H2![]() Cu+H2O,故A正确;
Cu+H2O,故A正确;
B.(1)中黑色固体变红,则a极有H2生成,a为阴极,发生的电极反应为2H2O+2e-=H2↑+2OH-,a极周围溶液中的Mg2+和OH-发生离子反应生成Mg(OH)2↓,故电极a附近溶液出现浑浊,故B正确;
C.b为阳极,有Cl2生成,则(3)中发生的离子反应为Cl2+S2-=S↓+2Cl-,可观察到(3)中溶液出现浑浊,故C正确;
D.(4)中发生的化学反应为2NaOH+Cl2=NaCl+NaClO+H2O,NaClO有漂白性,所以C中溶液红色褪去,即原因可能为NaClO的强氧化性褪色,故D错误;
故答案为D。

【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
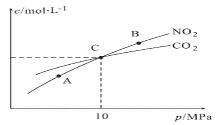
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。