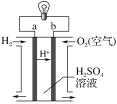
题目内容
【题目】已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(l) ΔH=-285 kJ/mol
② H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/mol
④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是_______________。
(2)H2的燃烧热为____________________;C的燃烧热为__________________。
(3)燃烧10 g H2生成液态水,放出的热量为___________________。
(4)CO的燃烧热为_________________;其热化学方程式为___________________。
【答案】①②③④285 kJ/mol393.5 kJ/mol1425 kJ151.7 kJ/molCO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol
【解析】
(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应:①H2(g)+![]() O2(g)=H2O(l)△H=-285kJmol-1,②H2(g)+
O2(g)=H2O(l)△H=-285kJmol-1,②H2(g)+ ![]() O2(g)=H2O(g)△H=-241.8kJmol-1,③C(s)+
O2(g)=H2O(g)△H=-241.8kJmol-1,③C(s)+ ![]() O2(g)=CO(g)△H=-110.5kJmol-1,④C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,以上4个反应均为放热反应,故答案为:①②③④;
O2(g)=CO(g)△H=-110.5kJmol-1,④C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1,以上4个反应均为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285kJmol-1,C的燃烧热为393.5kJ/mol,故答案为:285kJmol-1;393.5kJ/mol;
(3)依据反应①进行计算燃烧10gH2生成液态水放出的热量;
H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJmol-1
O2(g)=H2O(l)△H=-285.8kJmol-1
2g 285kJ
10g Q
Q=![]() =1425kJ,故答案为:1425kJ;
=1425kJ,故答案为:1425kJ;
(4)③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/mol,④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol,根据盖斯定律,将④-③得:CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol,故答案为:151.7 kJ/mol;CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:
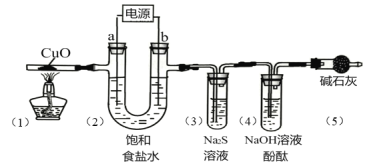
对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO