题目内容
6.6.4g Cu与过量硝酸(a mol/L,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol.(1)此时溶液中所含NO3-物质的量0.3mol;
(2)求生成的气体中NO2和NO的物质的量各为多少?(用含有a的式子表示)
分析 n(Cu)=6.4g64g/mol=0.1mol,n(HNO3)=amol/L×0.03L=0.03amol,
(1)根据氮原子守恒得反应后溶液中n(NO3-)=n(HNO3)(剩余)+2n[Cu(NO3)]=n(H+)+2n(Cu);
(2)根据N原子守恒得n(NOx)=n(HNO3)(原来)-n(HNO3)(剩余)-2n[Cu(NO3)],再结合转移电子相等计算两种氧化物物质的量分别是多少.
解答 解:n(Cu)=6.4g64g/mol=0.1mol,n(HNO3)=amol/L×0.03L=0.03amol,
(1)根据氮原子守恒得反应后溶液中n(NO3-)=n(HNO3)(剩余)+2n[Cu(NO3)]=n(H+)+2n(Cu)=0.1mol+2×0.1mol=0.3mol,
故答案为:0.3mol;
(2)根据N原子守恒得n(NOx)=n(HNO3)(原来)-n(HNO3)(剩余)-2n[Cu(NO3)]=0.03amol-0.1mol-0.1mol×2=(0.03a-0.3)mol,转移到电子的物质的量=0.1mol×2=0.2mol,
设生成的气体中NO2和NO的物质的量分别为xmol、ymol,结合转移电子相等得
{x+y=(0.03a−0.3)(5−4)x+(5−2)y=0.2,
{x=0.045a−0.55y=0.25−0.015a,
答:生成的气体中NO2和NO的物质的量分别为(0.045a-0.55)mol、(0.25-0.015a)mol.
点评 本题以Cu和硝酸的反应为载体考查氧化还原反应的计算,侧重考查分析计算能力,会利用原子守恒、转移电子守恒进行计算,难点是(2)题联立方程式组,题目难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
16.下列有关物质用途或现象以及反应方程式不正确的是( )
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO催化剂_N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) △_MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2高温_2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
14.将m mol Na2O2和n mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应后排出气体.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
(2)当排出气体只含H2O(g)和O2两种成分且物质的量相等时,则原固体混合物中m:n=2:3.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
| 序号 | mn | 固体成分 | 排出气体物质成分 |
| ① | <12 | Na2CO3 | |
| ② | =12 | Na2CO3 | O2、H2O |
| ③ | 12<mn<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
1.向10mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+) | |
| B. | x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)>c(AlO2-) | |
| D. | 滴加过程中,生成沉淀的最大物质的量为0.003mol |
18.现有Q、M、W、G四种原子依次增大的短周期元素,Q与M组成两种常见的气态化合物,其中一种是温室气体,另一种是强还原剂,M与G为与同主族,下列推断正确的是( )
| A. | 若M与W组成原子数为1:1、1:2型离子化合物,则W2G的水溶液含7种粒子 | |
| B. | 若W单质在QM2气体中燃烧生成黑色、白色两种固体,则W的原子序数与族序数之比为5 | |
| C. | 若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,M与W组成的化合物易升华 | |
| D. | 若M与W组成的化合物作光导纤维材料,则W单质及其氧化物都抗所有酸溶液的腐蚀 |

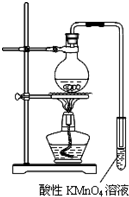 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH 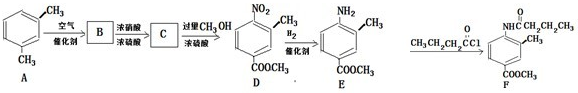
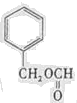
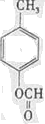
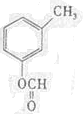
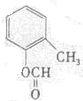 (写结构简式).
(写结构简式). 自来水生成流程示意图
自来水生成流程示意图