题目内容
5.有序排列是学习化学的重要方法,下列排序不正确的是( )| A. | 还原性强弱:F-<Cl-<I- | B. | 半径K+>Mg2+>Al3+>H+ | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
分析 A、非金属性越强,对应离子的还原性越弱;
B、电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小;
C、非金属性越强,气态氢化物越稳定;
D、金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A、非金属性越强,对应离子的还原性越弱,非金属性F>Cl>I,对应离子的还原性为F-<Cl-<I-,故A正确;
B、K+三个电子层,Mg2+和Al3+两个电子层,铝离子的核电荷数多,H+的半径最小,所以半径K+>Mg2+>Al3+>H+,故B正确;
C、非金属性Cl>S>P,气态氢化物的稳定性为PH3<H2S<HCl,故C错误;
D、金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D正确.
故选C.
点评 本题考查元素周期律,熟悉元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
15.化学反应的发生必然伴随有能量的转化,其最根本的原因是( )
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
16.下列有关物质用途或现象以及反应方程式不正确的是( )
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
13.下列离子方程式书写错误的是( )
| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
20.只用一种试剂鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是( )
| A. | NaOH | B. | Ba(OH)2 | C. | KSCN | D. | BaCl2 |
10.制造太阳能电池需要高纯度的硅,工业上制高纯度硅常用以下反应:
①3000℃Si(s)+3HCl(g)=SiHCl3(g)+H2(g) (放热反应)
②950℃SiHCl3(g)+H2 (g)=Si(s)+3HCl(g)
对上述两个反应的下列叙述中,错误的是( )
①3000℃Si(s)+3HCl(g)=SiHCl3(g)+H2(g) (放热反应)
②950℃SiHCl3(g)+H2 (g)=Si(s)+3HCl(g)
对上述两个反应的下列叙述中,错误的是( )
| A. | 两个反应都是氧化还原反应 | |
| B. | 两个反应都是置换反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 反应(2)是放热反应 |
14.将m mol Na2O2和n mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应后排出气体.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
(2)当排出气体只含H2O(g)和O2两种成分且物质的量相等时,则原固体混合物中m:n=2:3.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
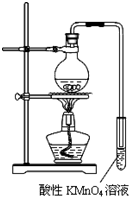 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O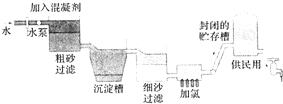 自来水生成流程示意图
自来水生成流程示意图