题目内容
19.某PbO、Pb2O3混合物中,铅、氧的物质的量之比为4:5,其中两种价态的铅的物质的量之比是1:1.分析 设PbO、Pb2O3的物质的量分别为xmol、ymol,根据铅、氧的物质的量之比为4:5确定x、y关系,进而计算两种价态的铅的物质的量之比.
解答 解:设PbO、Pb2O3的物质的量分别为xmol、ymol,铅、氧的物质的量之比为4:5,则:
(x+2y)mol:(x+3y)mol=4:5
整理得x:y=2:1
故+2价Pb与+3价Pb的物质的量之比为x:2y=1:1,
故答案为:1:1.
点评 本题考查物质的量的有关计算,侧重考查微粒数目的计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
9.下列离子方程式中,错误的是( )
| A. | 向AlCl3溶液中加入过量氨水:Al3++3 NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 向硝酸亚铁溶液中加入稀硫酸:3Fe2++NO3-+4H+═3Fe3++2H2O+NO↑ | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
10.制造太阳能电池需要高纯度的硅,工业上制高纯度硅常用以下反应:
①3000℃Si(s)+3HCl(g)=SiHCl3(g)+H2(g) (放热反应)
②950℃SiHCl3(g)+H2 (g)=Si(s)+3HCl(g)
对上述两个反应的下列叙述中,错误的是( )
①3000℃Si(s)+3HCl(g)=SiHCl3(g)+H2(g) (放热反应)
②950℃SiHCl3(g)+H2 (g)=Si(s)+3HCl(g)
对上述两个反应的下列叙述中,错误的是( )
| A. | 两个反应都是氧化还原反应 | |
| B. | 两个反应都是置换反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 反应(2)是放热反应 |
14.将m mol Na2O2和n mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应后排出气体.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
(2)当排出气体只含H2O(g)和O2两种成分且物质的量相等时,则原固体混合物中m:n=2:3.
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
7.相同状况下,4组混合气体:①体积比为3:1的NH3和N2②体积比为1:1的NO和NO2③体积比为1:1的NO2和O2④体积比为4:1的NO2和O2分别置于完全相同的试管里并倒置于水槽中,充分反应后液面上升的高度分别为h1、h2、h3、h4,则下列关系正确的( )
| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
8.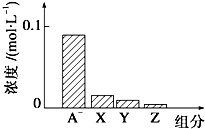 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA溶液显酸性 | |
| B. | 混合溶液中水电离出的C(OH-)、C(H+)相等 | |
| C. | 图中X、Y、Z分别代表OH-、HA-、H+ | |
| D. | 混合溶液中:C(Na+)=C(H2A)+C(HA-)+C(A2-) |
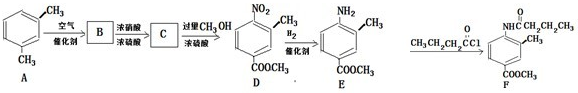
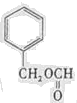
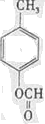
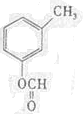
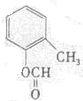 (写结构简式).
(写结构简式).