题目内容
冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AIF6:
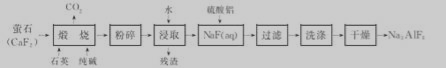
回答下列问题:
(1)Na3AIF6为助溶剂,冶炼铝的化学方程式为 。
(2)写出煅烧时总反应的化学方程式为________。
(3)煅烧后的固体在浸取前进行粉碎的目的是____,为达到相同目的,常温浸取时还可采取的措施是____。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:____。NaF溶液呈碱性,用离子方程式表示其原因: ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物 。
(5)97.5kg含CaF280%萤石(杂质不含氟元素)理论上可生产Na3 AIF6 kg(设生产过程中的每一步含氟物质均完全转化)。
练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
7.将三种黑色粉末组成的混合物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体,将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
4.下列说法正确的是( )
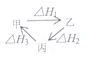

| A. | 甲、乙、丙三物质转化如图所示,则△H1=△H2+△H3 | |
| B. | 1molCO完全燃烧生成稳定氧化物放出热量为283.0KJ,则2 CO2(g)=2 CO(g)+O2(g),△H=+566.0KJ•mol-1 | |
| C. | 若N2(g)+3H2(g)?2NH3(g),△H=-92.4KJ•mol-1,故在某容器中充入1mol N2与3molH2充分反应后,放出的热量为92.4KJ | |
| D. | 常温下,稀HCl和稀NaOH溶液反应生成1molH2O放出热量为57.3 KJ,其热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq),△H=-57.3KJ |
11.常见有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥氧化反应 ⑦还原反应,其中可能在有机分子中引入羟基的反应类型是( )
| A. | ①②④ | B. | ⑤⑥⑦ | C. | ①②⑦ | D. | ③④⑤ |
12.C1O2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得C1O2:
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
| A. | KClO3在反应中是氧化剂 | |
| B. | 1mol KClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 在反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1mol KClO3参加反应有1mol电子转移 |


 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题: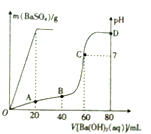 常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.
常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示. 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题: