题目内容
6. 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:(1)乙烯氧化法:在催化剂存在的条件下,可以看作先将乙烯氧化成乙醛,乙醛再氧化为乙酸.写出相应的化学反应方程式:CH2=CH2+O2$\stackrel{催化剂}{→}$CH3CHO、2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH.
(2)已知175℃、3.0MPa时:
甲醇取代反应①CH3OH(g)+HI(g)?CH3I(g)+H2O(g)△H1
碘代甲烷羟基化反应②CH3I(g)+CO(g)?CH3COI(g)△H2
CH3COI水解生成醋酸③CH3COI(g)+H2O(g)?CH3COOH(g)+HI(g)△H3
则甲醇羟基化法合成乙酸的总反应CH3OH(g)+CO(g)?CH3COOH(g)的△H与△H1、△H2、△H3之间的关系为△H=△H1+△H2+△H3,反应过程中的碘代甲烷是中间产物(“催化剂”、“中间产物”).
(3)检验产品中乙酸成分比较简便的实验操作是取少量产品溶于水配成溶液,滴加紫色石蕊试液,如果变红,则说明含有乙酸成分.
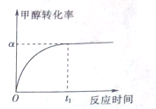
(4)175℃、3.0MPa时甲醇羟基化法合成乙酸的反应时间与甲醇转化率的关系如图(其中初始投料$\frac{n(CO)}{n(C{H}_{3}OH)}$=λ):
①若甲醇羟基化法合成乙酸的△H<0,为了提高甲醛的转化率,除了适当改变温度和压强外,还可以采取的措施有增加压强、降低温度.
②已知α和λ,用平衡分压代替平衡浓度列式丙计算平衡常数K=$\frac{α}{(1-α)×(λ-α)}$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
分析 (1)乙烯在催化剂存在条件下与氧气反应生成乙醛,乙醛与氧气进一步发生氧化反应生成乙酸,据此书写方程式;
(2)根据盖斯定律①+②+③得到CH3OH(g)+CO(g)?CH3COOH(g)进行计算;
(3)根据乙酸溶于水成酸性检验;
(4)①根据该反应为气体体积减小的放热反应分析,要想提高转化率,则使平衡向正反应方向移动;
②根据K=$\frac{c(CH{\;}_{3}COOH)}{c(CH{\;}_{3}OH)c(CO)}$进行计算.
解答 解:(1)乙烯在催化剂存在条件下与氧气反应生成乙醛,方程式为CH2=CH2+O2$\stackrel{催化剂}{→}$CH3CHO,乙醛与氧气进一步发生氧化反应生成乙酸,该反应为2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH,故答案为:为CH2=CH2+O2$\stackrel{催化剂}{→}$CH3CHO;2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;
(2)①CH3OH(g)+HI(g)?CH3I(g)+H2O(g)△H1
②CH3I(g)+CO(g)?CH3COI(g)△H2
③CH3COI(g)+H2O(g)?CH3COOH(g)+HI(g)△H3
①+②+③得CH3OH(g)+CO(g)?CH3COOH(g)△H=△H1+△H2+△H3;根据反应碘代甲烷为反应①的产物,反应②的反应物,所以反应过程中的碘代甲烷是中间产物;
故答案为:△H1+△H2+△H3;中间产物;
(3)因为乙酸溶于水成酸性,所以用紫色石蕊试液检验即可,具体操作为取少量产品溶于水配成溶液,滴加紫色石蕊试液,如果变红,则说明含有乙酸成分;
故答案为:取少量产品溶于水配成溶液,滴加紫色石蕊试液,如果变红,则说明含有乙酸成分;
(4)①要想提高转化率,则使平衡向正反应方向移动,又该反应为气体体积减小的放热反应,所以可以增加压强或者降低温度,故答案为:增加压强;降低温度;
②设开始时充入CH3OH(g)的浓度为1mol/L,则CO(g)的浓度为λmol/L,
由 CH3OH(g)+CO(g)?CH3COOH(g)
开始 1mol/L λmol/L 0
转化 α α α
平衡 1-α λ-α α
所以K=$\frac{c(CH{\;}_{3}COOH)}{c(CH{\;}_{3}OH)c(CO)}$=$\frac{α}{(1-α)×(λ-α)}$,
故答案为:$\frac{α}{(1-α)×(λ-α)}$.
点评 本题考查了有机反应方程式的书写、盖斯定律的应用以及化学平衡常数的计算,建立三段式是解答平衡计算是关键,题目难度中等.

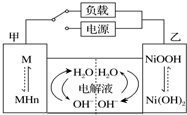 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
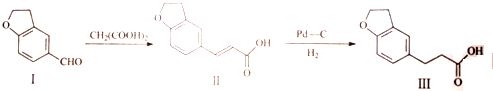
| A. | 可用浓溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1mol化合物Ⅰ最多能与3molH2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子含有2个醛基的芳香族化合物有10种 |
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | Y属于不饱和烃 | |
| D. | Y的二氯代物有三种 |
| A. | 利用蒸馏分离有机物时,明火尽量与接液器保持一定距离 | |
| B. | 做焰色反应实验时,铂丝需要在硫酸中蘸洗 | |
| C. | 实验室制取氨气时,收集装置必须洗净但无需干燥 | |
| D. | 甲烷与氧气反应时,需要黑纸遮挡避免灯光照射 |
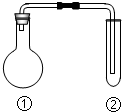 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )| ①中的反应 | ②中的现象 | 结论 | |
| A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
| B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
| C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
| X | Y | Z | R | |
| 主要化合价 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A. | 非金属性:Z<R<Y | |
| B. | T与R可以形成化合物:TR2 | |
| C. | X与R的单质均能使品红溶液褪色,且褪色原理相同 | |
| D. | T的最高价氧化物的水化物分别能与X、Y、Z的最高价氧化物反应 |