题目内容
11.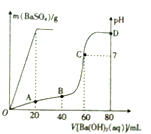 常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.
常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.(1)写出溶液中发生反应的离子方程式:Ba 2++SO4 2-═BaSO4、H++OH-=H2O.
(2)原混合溶液中硫酸的物质的量浓度为0.1mol•L-1,酸的物质的量浓度为0.4mol•L-1.
(3)在B点时的c(H+)为0.13mol/L,D点时的pH为13.(忽略混合时溶液体积的变化,结果保留2位有效数字)
分析 (1)溶液中发生反应的离子方程式:Ba 2++SO4 2-═BaSO4和H++OH-=H2O;
(2)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,故根据方程式计算硫酸的物质的量;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),继而计算HCl电离产生的氢离子物质的量,再根据c=$\frac{n}{V}$计算硫酸、盐酸的物质的量浓度;
(3)B点时硫酸反应,而盐酸未反应,计算混合后氢离子的浓度,根据pH=-lgc(H+).
解答 解:(1)溶液中发生反应的离子方程式:Ba 2++SO4 2-═BaSO4和H++OH-=H2O,故答案为:H++OH-=H2O;
(2)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,只有硫酸与氢氧化钡反应,而盐酸未反应,此时加入氢氧化钡的物质的量为:0.02L×0.4mol•L-1=0.008mol,则:
H2SO4+Ba(OH)2═BaSO4↓+2H2O
1 1 1
0.008mol 0.008mol 0.008mol
由图可知,pH=7时,消耗60mLBa(OH)2溶液,此时加入氢氧化钡的物质的量=0.06L×0.4mol•L-1=0.024mol,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.024mol×2=0.048mol,故n(HCl)=0.048mol-0.008mol×2=0.032mol,所以硫酸的物质的量浓度为:$\frac{0.008}{0.08}$=0.1mol/L,盐酸的物质的量浓度为$\frac{0.032}{0.08}$=)=0.4mol/L,故答案为:0.1;0.4;
(3)B点:n(H+)=0.4mol/L×0.08L-2×0.4mol/L×(0.04L-0.02L)=0.016mol
c(H+)=$\frac{n}{V}$=$\frac{0.016mol}{0.08L+0.04L}$=0.13mol/L
D点:n[Ba(OH)2]=CV=0.4mol/L×(0.08L-0.06L)=0.008mol
n(OH-)=2n[Ba(OH)2]=2×0.008mol=0.016mol
c(OH-)=$\frac{0.016mol}{0.08L+0.08L}$=0.1mol/L
c(H+)=$\frac{Kw}{C(O{H}^{-})}$=10-13mol/L
所以:pH=13
故答案为:0.13mol/L;13.
点评 本题考查混合物的计算,为高频考点,题目难度中等,把握图象中各阶段发生的反应是解答本题的关键,注意利用反应方程式及离子方程式进行计算.

 阅读快车系列答案
阅读快车系列答案| A. | 利用蒸馏分离有机物时,明火尽量与接液器保持一定距离 | |
| B. | 做焰色反应实验时,铂丝需要在硫酸中蘸洗 | |
| C. | 实验室制取氨气时,收集装置必须洗净但无需干燥 | |
| D. | 甲烷与氧气反应时,需要黑纸遮挡避免灯光照射 |
| A. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- | |
| B. | 物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |

| A. | 图①常用于分离沸点相差较大的液体混合物 | |
| B. | 图②用于吸收尾气SO2 | |
| C. | 图③用于干燥、收集少量NH3 | |
| D. | 采用图④的操作排出碱式滴定管尖嘴处的气泡 |
| A. | 0.2mol•L-1 H2C2O4溶液:C(H+)>C(H2C2O4)>C(H2C2O4-)>C (C2O42-) | |
| B. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后所得溶液的PH<7 | |
| C. | 在(NH4)2SO4溶液中,C(NH4+)+C(NH3•H2O)=$\frac{1}{2}$C(SO42-) | |
| D. | 叠氮酸(HN3)与醋酸性相似,0.1 mol•L-1NaN3溶液:C (N3-)>C(Na+)>C(OH-)>C (H+) |
下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有漂白性 |
B | C2H5OH与浓硫酸混合后加热到170℃ | 生成的气体使酸性KMnO4溶液褪色 | 反应一定生成了乙烯 |
C | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊 | 试纸变为蓝色 | NO3-被还原为NH3 |
D | 向NaSiO3溶液中滴加I滴酚酞试液,然后逐滴加入稀盐酸至红色褪去 | 产生胶装沉淀 | 非金属性:Cl>Si |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
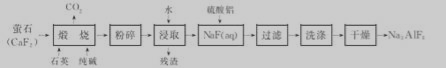
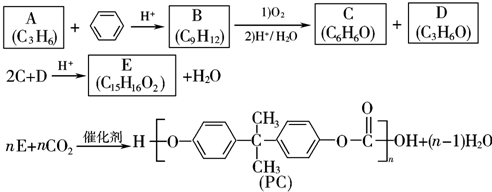
 .
. .
. (写出结构简式).
(写出结构简式).