题目内容
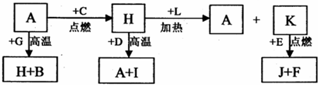 A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素:D 元素和 E 元素在周期表中相邻,G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体,H 是黑色晶体,以上物质相互间的转化关系如图所示:
A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素:D 元素和 E 元素在周期表中相邻,G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体,H 是黑色晶体,以上物质相互间的转化关系如图所示:请回答下列问题:
(1)元素 A 在元素周期表中的位置为
四
四
(周期)VIII
VIII
(族).(2)写出 K 的电子式
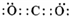
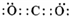
(3)写出 H 和 D 反应的化学方程式
3Fe3O4+8Al
4A12O3+9Fe
| ||
3Fe3O4+8Al
4A12O3+9Fe
.
| ||
(4)D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
3Fe3O4+8Al
4A12O3+9Fe;
| ||
3Fe3O4+8Al
4A12O3+9Fe;
.
| ||
(5)写出 A 与 G 反应的化学方程式
3Fe+4H2O ( g )
Fe3O4+4H2
| ||
3Fe+4H2O ( g )
Fe3O4+4H2
.
| ||
(6)K 与 E 反应时产生的现象有
镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒
镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒
,该反应的化学方程式为2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
分析:A、B、C、D、E、F 是常见单质,其中A是用量最大,应用最广泛的金属判断为Fe;元素 D 是地壳中含量最多的金属元素判断为Al:G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体判断为H2O,H 是黑色晶体结合转化关系判断为Fe3O4,说明C为O2,A(Fe)+G(H2O)=H(Fe3O4)+B(H2),所以G为H2O,H为Fe3O4,B为H2,H(Fe3O4)+D(Al)=A(Fe)+I(Al2O3);依据H+L=A+K可知,L为为CO,K为CO2,D 元素和 E 元素在周期表中相邻,结合K+E=J+F推断E为Mg;J为MgO,F为C;分析推断出的物质符合转化关系,依据物质回答问题.
解答:解:A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属判断为Fe;元素 D 是地壳中含量最多的金属元素判断为Al:G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体判断为H2O,H 是黑色晶体结合转化关系判断为Fe3O4,说明C为O2,A(Fe)+G(H2O)=H(Fe3O4)+B(H2),所以G为H2O,H为Fe3O4,B为H2,H(Fe3O4)+D(Al)=A(Fe)+I(Al2O3);依据H+L=A+K可知,L为为CO,K为CO2,D 元素和 E 元素在周期表中相邻,结合K+E=J+F推断E为Mg;J为MgO,F为C;
( l )元素 A 为Fe,在元素周期表中的位置为:第四周期,VIII族,故答案为:四;VIII;
( 2 ) K 为CO2,二氧化碳的电子式为: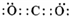 ,故答案为:
,故答案为: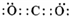 ;
;
( 3 ) H (Fe3O4)和 D (Al)反应的化学方程式:3Fe3O4+8Al
4A12O3+9Fe,故答案为:3Fe3O4+8Al
4A12O3+9Fe;
( 4 )D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:2Al+2OH-+2H2O=2A1O2-+3H2↑,故答案为:2Al+2OH-+2H2O=2A1O2-+3H2↑;
( 5 )A (Fe)与 G(H2O) 反应的化学方程式为:3Fe+4H2O ( g )
Fe3O4+4H2 ,故答案为:3Fe+4H2O ( g )
Fe3O4+4H2 ;
( 6 )K(CO2) 与 E(Mg) 反应时产生的现象为:镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒,反应的化学方程式为2Mg+CO2
2MgO+C,
故答案为:镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒;2Mg+CO2
2MgO+C;
( l )元素 A 为Fe,在元素周期表中的位置为:第四周期,VIII族,故答案为:四;VIII;
( 2 ) K 为CO2,二氧化碳的电子式为:
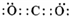 ,故答案为:
,故答案为: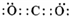 ;
;( 3 ) H (Fe3O4)和 D (Al)反应的化学方程式:3Fe3O4+8Al
| ||
| ||
( 4 )D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:2Al+2OH-+2H2O=2A1O2-+3H2↑,故答案为:2Al+2OH-+2H2O=2A1O2-+3H2↑;
( 5 )A (Fe)与 G(H2O) 反应的化学方程式为:3Fe+4H2O ( g )
| ||
| ||
( 6 )K(CO2) 与 E(Mg) 反应时产生的现象为:镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒,反应的化学方程式为2Mg+CO2
| ||
故答案为:镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒;2Mg+CO2
| ||
点评:本题考查了物质转化关系的应用,物质性质的应用,电子式书写,化学方程式的书写分析,主要考查铁及其化合物性质的分析判断,题目难度中等.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.