题目内容
16.下列物质的电子式书写正确的是( )| A. | 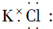 | B. |  | ||
| C. | 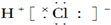 | D. | 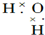 |
分析 A、氯化钾为离子化合物,电子式中需要标出阴阳离子所带电荷;
B、Na2O2是钠离子和过氧根离子构成的离子化合物;
C、HCl中Cl原子周围8个电子,H原子周围2个电子;
D、水为共价化合物,分子中存在2个氧氢键,氧原子最外层为8电子.
解答 解:A、KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ,故A错误;
,故A错误;
B、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故B正确;
,故B正确;
C、HCl中Cl原子周围8个电子,H原子周围2个电子,所以HCl的电子式为 ,故C错误;
,故C错误;
D、H2O中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故D错误,
,故D错误,
故选B.
点评 本题考查电子式的书写,难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.Y、Z三种金属,X、Y组成原电池,X是负极;把Z放入X的硝酸盐溶液中,Z表面有X析 出.三者的金属活动性顺序是( )
| A. | X>Y>Z | B. | Z>X>Y | C. | X>Z>Y | D. | Y>X>Z |
11.下列各组性质的比较,正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
1.苹果酸的结构简式为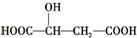 ,下列说法正确的是( )
,下列说法正确的是( )
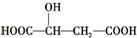 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
8.某主族元素R的最高化合价与最低负化合价的代数和为2,下列叙述可能正确的是( )
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
5. 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

(4)加NaHCO3时,混合液pH值应控制在4.4-7.5之间.
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.

 ;
; 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.