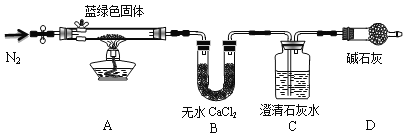
题目内容
【题目】分别用浓度均为0.5 mol/L的NH3·H2O和NaOH溶液,滴定20 mL 0.01 mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
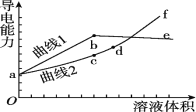
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d~f段导电能力升高的原因是发生了反应Al(OH)3+OH-===2H2O+AlO2-
【答案】C
【解析】
溶液中离子浓度越大,导电性越强;分别用浓度均为![]() 和NaOH溶液滴定
和NaOH溶液滴定![]() 溶液,一水合氨滴入发生反应:
溶液,一水合氨滴入发生反应:![]()
![]() ↓
↓![]() ,氢氧化钠溶液滴入发生的反应为:
,氢氧化钠溶液滴入发生的反应为:![]() ↓
↓![]() ,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2为氢氧化钠滴入的反应。
,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2为氢氧化钠滴入的反应。
A.一水合氨滴入发生反应: ![]()
![]() ↓
↓![]() ,氢氧化钠溶液滴入发生的反应为:
,氢氧化钠溶液滴入发生的反应为: ![]() ↓
↓![]() ,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,故A错误;
,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,故A错误;
B.b点为硫酸铵溶液,铵根水解溶液显酸性,d点是NaAlO2溶液,偏铝酸根离子水解溶液显碱性,故B错误;
C.b点为硫酸铵溶液,铵根水解溶液显酸性,溶液中离子浓度大小关系为![]() ,所以C选项是正确的;
,所以C选项是正确的;
D.d点是NaAlO2溶液,d点以后氢氧化钠过量,溶液中离子浓度增大,导电性增强,故D错误;
所以C选项是正确的。

练习册系列答案
相关题目