题目内容
【题目】下列实验所用试剂、现象和结论均正确的是
选项 | 实验装置 | 现象 | 结论 |
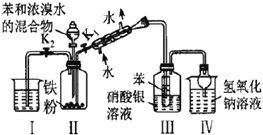
A |
| 装置Ⅲ中有浅黄色沉淀 | 苯和浓溴水发生取代反应 |
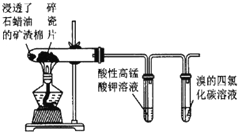
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有不饱和烃 |
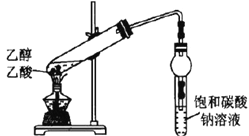
C |
| 盛有饱和碳酸钠溶液的试管中,上方出现油状液体 | 制备乙酸乙酯 |
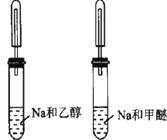
D |
| 甲醚有气泡 | 鉴别乙醇与甲醚(CH3OCH3) |
A. A B. B C. C D. D
【答案】B
【解析】
A.制取溴苯时应使用苯和液溴,不能使用浓溴水,A项错误;B.石蜡油的主要成分是烃的混合物,在碎瓷片的催化作用下,石蜡油会裂(分)解,产生中含有烯烃等不饱和烃,通过观测酸性高锰酸钾、溴的四氯化碳溶液的褪色,的确可以证明产物中有不饱和烃,B项正确;C.制备乙酸乙酯时,需要加入浓硫酸。浓硫酸作为催化剂,可极大加快反应速率,不然反应进行非常慢;同时浓硫酸作为吸水剂,可使平衡向生成乙酸乙酯的方向移动(实验中采取加热方式,可以使乙酸乙酯及时蒸发,利于平衡右移);D.甲醚与钠并不反应,故与金属钠接触时不会有气泡产生,D项错误;所以答案选B项。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。