题目内容
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
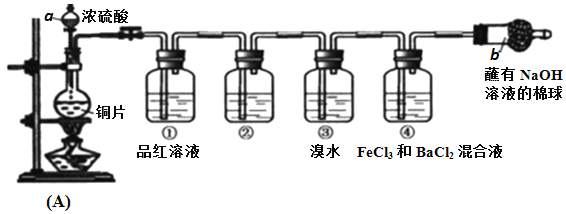
请回答:
(1)写出A反应装置中的化学方程式:____________
(2)棉球中NaOH溶液的作用是________________
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_________。
A.澄清石灰水 B.无色酚酞试液 C.碘水 D.紫色石蕊试液
(4)下列说法正确的是____________。
A.先向装置中加入试剂(药品),再进行气密性检查
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)写出洗气瓶③中反应的化学方程式:_____________
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O 吸收尾气,防止SO2污染大气 AD D Br2 + SO2 + 2H2O=2HBr +H2SO4
CuSO4+SO2 ↑+2H2O 吸收尾气,防止SO2污染大气 AD D Br2 + SO2 + 2H2O=2HBr +H2SO4
【解析】
(1)A中铜与浓硫酸反应生成硫酸铜、二氧化硫、水;(2)二氧化硫有毒,能污染空气,NaOH与二氧化硫反应生成亚硫酸钠和水;(3)SO2是酸性氧化物,能与水反应生成亚硫酸,能与氢氧化钙反应生成亚硫酸钙沉淀和水;(4)A.气体制备实验,先进行气密性检查,再加入试剂(药品); B.只需打开分液漏斗的旋塞,液体不能顺利滴下;
C.SO2与溴水反应,体现SO2的还原性; D.Fe3+把SO2氧化为SO42-,所以洗气瓶④中可观察到白色沉淀产生;(5)SO2与溴水反应,生成硫酸和氢溴酸。
(1)A中铜与浓硫酸反应生成硫酸铜、二氧化硫、水,反应方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O;(2)NaOH与二氧化硫反应生成亚硫酸钠和水,棉球中NaOH溶液的作用是吸收尾气,防止SO2污染大气;(3)SO2是酸性氧化物,能与水反应生成亚硫酸,能与氢氧化钙反应生成亚硫酸钙沉淀和水,为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是澄清石灰水或紫色石蕊试液,故选AD;(4)A.气体制备实验,先进行气密性检查,再加入试剂(药品),故A错误; B.分液时,要先取下分液漏斗口部的玻璃塞,再打开旋塞,即可使液体顺利滴下,故B错误; C.SO2与溴水反应,体现SO2的还原性,故C错误; D.因为二氧化硫通入氯化钡溶液不能生成沉淀、Fe3+可以把SO2氧化为SO42-,所以洗气瓶④中可观察到有白色沉淀生成,该现象可说明SO2具有还原性,故D正确。(5)SO2与溴水反应,生成硫酸和氢溴酸,反应方程式是Br2 + SO2 + 2H2O=2HBr +H2SO4。
CuSO4+SO2 ↑+2H2O;(2)NaOH与二氧化硫反应生成亚硫酸钠和水,棉球中NaOH溶液的作用是吸收尾气,防止SO2污染大气;(3)SO2是酸性氧化物,能与水反应生成亚硫酸,能与氢氧化钙反应生成亚硫酸钙沉淀和水,为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是澄清石灰水或紫色石蕊试液,故选AD;(4)A.气体制备实验,先进行气密性检查,再加入试剂(药品),故A错误; B.分液时,要先取下分液漏斗口部的玻璃塞,再打开旋塞,即可使液体顺利滴下,故B错误; C.SO2与溴水反应,体现SO2的还原性,故C错误; D.因为二氧化硫通入氯化钡溶液不能生成沉淀、Fe3+可以把SO2氧化为SO42-,所以洗气瓶④中可观察到有白色沉淀生成,该现象可说明SO2具有还原性,故D正确。(5)SO2与溴水反应,生成硫酸和氢溴酸,反应方程式是Br2 + SO2 + 2H2O=2HBr +H2SO4。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
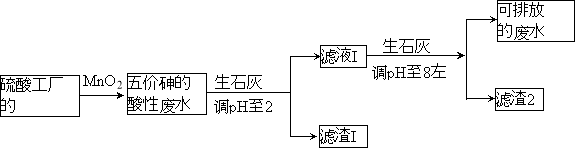
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
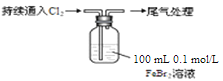
【题目】某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作 | 现 象 |
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
试管 | 操作 | 现象 | 结论 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
| Cl2的氧化性强于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 |
|
c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。
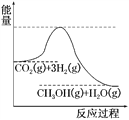
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2