题目内容
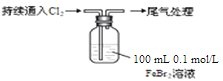
【题目】某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作 | 现 象 |
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
试管 | 操作 | 现象 | 结论 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
| Cl2的氧化性强于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 |
|
c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
【答案】(1)MnO2+4HCl![]() MnCl2+Cl2↑+2H2O; (1分)
MnCl2+Cl2↑+2H2O; (1分)
(2)Fe2++2H2O![]() Fe(OH)2+2H+ (1分 )
Fe(OH)2+2H+ (1分 )
(3)取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;(2分)
取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。 (2分)
(4)a.溶液变成红色(1分)
b.氧化性Fe3+ <Br2或 还原性Fe2+ >Br- (1分)
c.取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡(1分)
结论:猜测①是正确的。(1分)
【解析】
试题(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)pH≈4的原因是亚铁离子水解使溶液显酸性,离子方程式是Fe2++2H2O![]() Fe(OH)2+2H+
Fe(OH)2+2H+
(3)溶液变成黄色,若①对,溶液中存在Fe3+,取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;
若②对,溶液中存在溴单质,取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。
(4)a.Cl2的氧化性强于Fe3+,所以氯气将亚铁离子氧化成Fe3+,滴加KSCN溶液,溶液变红;
b.CCl4层没有明显变化,说明Fe3+不能将Br-氧化生成Br2,结论是氧化性Fe3+ <Br2或 还原性Fe2+ >Br-
c.验证氯气的氧化性强于单质溴氧化性,需进行的操作是取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡 ; 结论:猜测①是正确的

 习题精选系列答案
习题精选系列答案