题目内容
12.一定条件下,在一容积为4L的密闭容器中通入0.4molN2和1.2molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0(1)当进行到第4分钟时达到平衡,生成NH3为0.4mol,则从开始到达平衡时NH3的平均速率v(NH3)=0.025mol/(L•min)(注明单位).
(2)该条件下,反应的平衡常数表达式K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$,若降低温度,K值将增大(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将向正反应方向移动(“向逆反应方向”、“向正反应方向”或“不”).
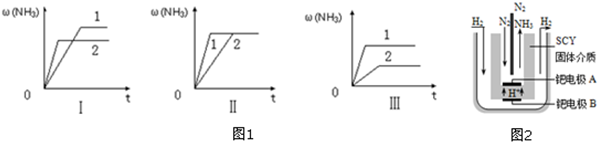
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图1.下列说法正确的是c(填序号):
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
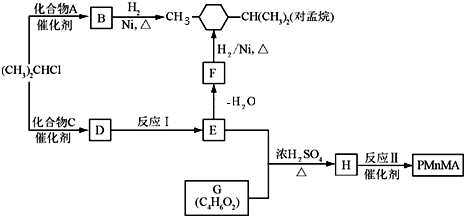
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置(如图2),H2和N2可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应为N2+6e-+6H+═2NH3.
分析 (1)依据化学反应速率概念V=$\frac{△c}{△t}$计算得到;
(2)依据化学方程式和化学平衡常数概念写出平衡常数表达式;反应是吸热反应;
(3)依据平衡移动原理分析,缩小体积是增大压强;
(4)a.增大压强平衡右移;
b.升高温度平衡逆向移动;
c.催化剂不影响平衡移动;
(5)根据合成反应的条件和水的状态角度来考虑,根据电解池的工作原理:电解池的阴极发生得电子的还原反应.
解答 解:(1)当进行到第4分钟时达到平衡,生成NH3为0.4mol,则从开始到达平衡时NH3的平均速率v(NH3)=$\frac{\frac{0.4mol}{4L}}{4min}$=0.025 mol/(L•min),
故答案为:0.025 mol/(L•min);
(2)N2(g)+3H2(g)?2NH3(g )△H<0,依据化学方程式书写反应的平衡常数K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$,反应是放热反应,温度降低平衡向放热反应方向进行,平衡正向进行,平衡常数增大;
故答案为:$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$;增大;
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,压强增大,平衡向气体体积减小的方向进行,平衡正向进行;
故答案为:向正反应方向;
(4)A.先拐先平,压强大,增大压强平衡右移,氨气的含量应增大,故a错误;
b.升高温度平衡逆向移动,氨气的含量减小,图象中氨气含量不符合变化规律,故b错误;
c.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故c正确;
故答案为:c;
(5)在电解法合成氨的电解池中,钯电极A是电解池的阴极,氨气发生氧化反应:N2+6e-+6H+═2NH3,故答案为:N2+6e-+6H+═2NH3.
点评 本题考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素、电极反应式书写等知识点,注意图象分析方法和平衡移动原理的分析应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 改进汽车尾气净化技术,可以减少大气污染物的排放 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生的发生密切相关,是雾霾天气的主要原因 | |
| C. | 推广燃煤脱硫技术可以降低SO2对大气的污染 | |
| D. | CO、SO2、NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在 |
| A. | 12种 | B. | 14种 | C. | 16种 | D. | 18种 |
| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
| A. | 稀硝酸 | B. | 硝酸铜 | C. | 稀盐酸 | D. | 氢氧化钠 |
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |


 .
. .
. .
. .
.