题目内容
【题目】有五种化合物是分别由以下原子![]() 团
团![]() 中的两种不同的原子
中的两种不同的原子![]() 团
团![]() 组成的:
组成的:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和
。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和![]() ,C是D的同分异构体,E可在碱性条件下和
,C是D的同分异构体,E可在碱性条件下和![]() 反应生成B。按要求回答问题
反应生成B。按要求回答问题![]() 提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用
提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用![]()
(1)C的结构简式__________;
(2)A与D的关系______________________![]() 填序号
填序号![]() ;
;
①同系物 ②同分异构体 ③同种物质 ④同位素 ⑤同素异形体
(3)请写出相对分子质量与D相等且属于饱和一元醇的所有同分异构体的结构简式______;
(4)请写出下列反应的方程式:![]() 转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
【答案】HCOOCH3 ① CH3CH2CH2OH或CH3CHOHCH3 CH3Br+OH-![]() CH3OH+Br- HCOOCH3+NaOH→HCOONa+CH3OH
CH3OH+Br- HCOOCH3+NaOH→HCOONa+CH3OH
【解析】
A是一种能发生银镜反应的酸,说含有醛基和羧基,A为甲酸;它跟B在一定条件下可生成C和H2O,说明B为醇,C为酯,则B中含有羟基只能为CH3OH,A和B在一定条件下可生成HCOOCH3和H2O,C为HCOOCH3,C是D的同分异构体,则D为CH3COOH;E可在碱性条件下和H2O反应生成B,则E为CH3Br,据此分析解答。
根据上述分析,A为HCOOH,B为CH3OH,C为HCOOCH3,D为CH3COOH,E为CH3Br。
(1)C为HCOOCH3,故答案为:HCOOCH3;
(2)A为HCOOH,D为CH3COOH,结构相似,分子组成上相差1个CH2,互为同系物,故答案为:①;
(3)D为乙酸,相对分子质量相等的醇为C3H7OH,同分异构体的结构简式有:CH3CH2CH2OH或CH3CHOHCH3,故答案为:CH3CH2CH2OH或CH3CHOHCH3;
(4)CH3Br→CH3OH转化的离子方程式:CH3Br+OH-![]() CH3OH+Br-;HCOOCH3与氢氧化钠水溶液反应的化学方程式:HCOOCH3+NaOH→HCOONa+CH3OH,故答案为:CH3Br+OH-
CH3OH+Br-;HCOOCH3与氢氧化钠水溶液反应的化学方程式:HCOOCH3+NaOH→HCOONa+CH3OH,故答案为:CH3Br+OH-![]() CH3OH+Br-;HCOOCH3+NaOH→HCOONa+CH3OH。
CH3OH+Br-;HCOOCH3+NaOH→HCOONa+CH3OH。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
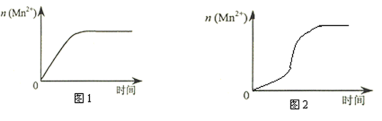
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等