题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
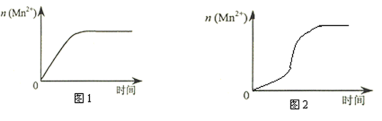
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
【答案】3.0 4.0 其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大 1.0×10-2 mol / (L·min) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 与实验1比较,溶液褪色所需时间短 或:所用时间(t)小于1.5min MnO42--e-=MnO4-
【解析】
(1)研究外界条件对化学反应速率的影响,需用控制单一变量法,根据表格数据可知变量为草酸的浓度,则为使混合液中硫酸和高锰酸钾的浓度相同,需用水控制溶液的总体积相同,硫酸和高锰酸钾的用量也相同;
(2)从表中数据可知改变的条件是草酸的浓度,其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
(3)根据公式![]() 计算用高锰酸钾表示的反应速率;
计算用高锰酸钾表示的反应速率;
(4)①由图可知反应开始后速率增大的比较快,说明生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②由表格中数据可知第4组与第1组除了A固体外,其余均相同,则与实验1作对比实验,为验证假设,表中加入的固体A是MnSO4;
③若该小组同学提出的假设成立,则第4组反应速率快;
(5)根据题意知,Mn元素化合价由+6价升高为+7价,则电解时,阳极发生的电极反应式为MnO42- - e- =MnO4-。
(1)溶液的总体积相同,硫酸和高锰酸钾的浓度相同,用量也相同。根据实验1可知溶液总体积为10mL,所以V1=3.0mL,V2=4.0mL;
故答案为:3.0;4.0;
(2)从表中数据可知改变的条件是草酸的浓度,其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
故答案为:其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
(3)反应中消耗高锰酸钾的浓度是![]() ,v(KMnO4)=
,v(KMnO4)=![]() ;
;
故答案为:1.0×10-2 mol/(L·min);
(4)①由图可知反应开始后速率增大的比较快,说明生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②由表格中数据可知第4组与第1组除了A固体外,其余均相同,则与实验1作对比实验,为验证假设,表中加入的固体A是MnSO4;
故答案为:MnSO4;
③若该小组同学提出的假设成立,则第4组反应速率快,应观察到的现象是实验1比较,溶液褪色所需时间短或所用时间(t)小于1.5min,从而说明Mn2+对该反应有催化作用;
故答案为:与实验1比较,溶液褪色所需时间短或所用时间(t)小于1.5min;
(5)根据题意知,工业上可用电解K2MnO4溶液的方法制取KMnO4,Mn元素化合价由+6价升高为+7价,则电解时,阳极发生的电极反应式为MnO42- - e- =MnO4-;
故答案为:MnO42- - e- =MnO4-。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
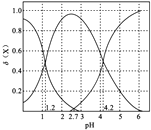
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
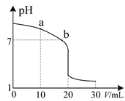
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如下。
变化如下。
序号 |
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
| p>② | 方法II |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①、②、③的化学平衡常数的关系:![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①前20min的平均反应速率![]()
【题目】恒温恒容下,向2L密闭容器中加入![]() 和
和![]() ,发生反应:
,发生反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
|
0 |
|
| 0 |
2 |
| ||
4 |
|
下列说法正确的是( )
A.反应在![]() 内的平均速率为
内的平均速率为![]() mol/(L·min)
mol/(L·min)
B.反应在![]() 内容器内气体的密度没有变化
内容器内气体的密度没有变化
C.若升髙温度,反应的平衡常数变为![]() ,则正反应为放热反应
,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入![]() 和
和![]() ,达到平衡时
,达到平衡时![]()


