题目内容
【题目】向容积固定为2L的密闭容器中充入![]() 和
和![]() ,发生如下反应:①
,发生如下反应:①![]()
![]() ②
②![]() 测得
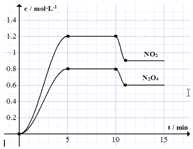
测得![]() 和
和![]() 的浓度变化如图所示,
的浓度变化如图所示,![]() 维持容器温度为
维持容器温度为![]() ,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是
,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是![]()
![]()
A.前5min反应的平均速率![]()
B.![]() 时反应①的化学平衡常数
时反应①的化学平衡常数![]()
C.10min时改变反应条件可能是降低温度
D.若起始时向该容器中充入![]() 和
和![]() ,
,![]() 达到平衡时,
达到平衡时,![]() 的物质的量浓度与图中
的物质的量浓度与图中![]() 的不同
的不同
【答案】B
【解析】
A. 5min时,容器内c(NO2)=1.2mol/L、c(N2O4)=0.8mol/L,说明NO的浓度改变了![]() ,所以平均速率是0.56 mol/(L·min),故A错误;
,所以平均速率是0.56 mol/(L·min),故A错误;
B. ![]() 时反应达到平衡,NO的浓度改变了
时反应达到平衡,NO的浓度改变了![]() 、O2的浓度改变
、O2的浓度改变![]() ,剩余NO的浓度为2 mol/L 、O2的浓度为1 mol/L,
,剩余NO的浓度为2 mol/L 、O2的浓度为1 mol/L, ![]() 的化学平衡常数
的化学平衡常数![]() ,故B正确;
,故B正确;
C.![]() 时二氧化氮和四氧化二氮浓度都降低,所以平衡时向逆向移动的,而逆反应是吸热反应,降低温度应该向放热反应方向移动,故C错误;
时二氧化氮和四氧化二氮浓度都降低,所以平衡时向逆向移动的,而逆反应是吸热反应,降低温度应该向放热反应方向移动,故C错误;
D. 根据一边倒的原则,若起始时向该容器中充入![]() 和
和![]() ,与充入
,与充入![]() 和
和![]() 等效,所以
等效,所以![]() 达到平衡时,
达到平衡时,![]() 的物质的量浓度与图中
的物质的量浓度与图中![]() 的相同,故D错误。
的相同,故D错误。
故选B。

【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如下。
变化如下。
序号 |
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
| p>② | 方法II |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①、②、③的化学平衡常数的关系:![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①前20min的平均反应速率![]()
【题目】恒温恒容下,向2L密闭容器中加入![]() 和
和![]() ,发生反应:
,发生反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
|
0 |
|
| 0 |
2 |
| ||
4 |
|
下列说法正确的是( )
A.反应在![]() 内的平均速率为
内的平均速率为![]() mol/(L·min)
mol/(L·min)
B.反应在![]() 内容器内气体的密度没有变化
内容器内气体的密度没有变化
C.若升髙温度,反应的平衡常数变为![]() ,则正反应为放热反应
,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入![]() 和
和![]() ,达到平衡时
,达到平衡时![]()
【题目】某小组探究元素周期律性质递变规律,设计如下实验。

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:____。装置B所盛试剂是_____,其作用是_____;C中反应的离子方程式是_____________。
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是_____。
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有____、______胶头滴管玻璃片、试管。
(2)请完成下列表格
实验方案 | 实验现象 | 化学方程式 |
① | A | 2Na +2H2O=2NaOH +H2↑ |
② | ____ | ____ |
③ | E | Mg +2HCl=MgCl2 +H2↑ |
④ | D | 2Al +6HC1=2AlCl3 +H2↑ |
⑤ | ____ | ____ |
(3)由实验得出有关元素周期律结论:_________。