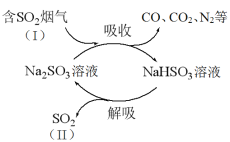
题目内容
【题目】为测定某抗酸药中碳酸钙固体的纯度(另一种成分为淀粉),称取12.5g此药片置于烧杯中,加入过量的稀盐酸,测得反应过程中烧杯和药品的总重量随时间的变化数据如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
烧杯和药品的总重/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
计算:(1)共收集到标准状况下CO2的体积____________________;
(2)该样品中碳酸钙的质量分数________________________。
【答案】2.24L 80%
【解析】
碳酸钙与稀盐酸反应生成二氧化碳、氯化钙和水,反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,结合表格数据得到生成的CO2的质量,根据方程式计算碳酸钙的质量,从而计算出样品中碳酸钙质量分数。
(1)由表格数据可知,20~30s内,烧杯和药品的总质量不变,说明反应结束,此时放出二氧化碳的质量为310.0g-305.6g=4.4g,根据公式![]() 可得,共收集到标准状况下二氧化碳的体积
可得,共收集到标准状况下二氧化碳的体积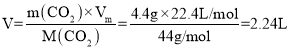 ,故答案为:2.24L;
,故答案为:2.24L;
(2)设样品中碳酸钙的质量为xg,则有
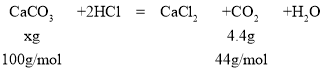
![]() ,解得x=10g,则样品中碳酸钙质量分数
,解得x=10g,则样品中碳酸钙质量分数![]() ,故答案为:80%。
,故答案为:80%。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目