ЬтФПФкШн
ЁОЬтФПЁПAЁЂBЁЂCЮЊдзгађЪ§вРДЮЕндіЕФЧАЫФжмЦкЕФдЊЫиЃЌAЕФЕквЛЕчРыФмНщгкУОКЭСђСНдЊЫижЎМфЃЌAЕЅжЪОЇЬхЕФОЇАћНсЙЙШчЭМ2ЫљЪОЁЃBЕФМлЕчзгХХВМЮЊ(n+1)sn(n+1)pn+2ЃЌCЮЛгкдЊЫижмЦкБэЕФdsЧјЃЌЦфЛљЬЌдзгВЛДцдкВЛГЩЖдЕчзгЁЃBгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФОЇАћШчЭМ3ЫљЪОЁЃ
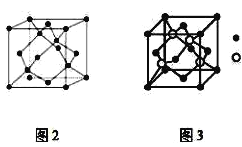
ЃЈ1ЃЉAЕЅжЪОЇЬхЪєгк__ОЇЬх(ЬюОЇЬхРраЭ)ЁЃЦфдзгдгЛЏЗНЪНЮЊ__ЁЃ
ЃЈ2ЃЉBгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФЛЏбЇЪН__ЁЃ
ЃЈ3ЃЉBгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФУмЖШЮЊag/cm3ЃЌдђBдзгжЎМфзюНќОрРыЮЊ__cmЁЃ
ЁОД№АИЁПдзг sp3 ZnS 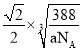 cm
cm
ЁОНтЮіЁП
AЁЂBЁЂCЮЊдзгађЪ§вРДЮЕндіЕФЧАЫФжмЦкЕФдЊЫиЃЌBЕФМлЕчзгХХВМЮЊЃЈn+1ЃЉsnЃЈn+1ЃЉpn+2ЃЌЖјn=2ЃЌЙЪBЮЊSдЊЫиЃЛCЮЛгкЮЛгкдЊЫижмЦкБэЕФdsЧјЃЌЦфЛљЬЌдзгВЛДцдкВЛГЩЖдЕчзгЃЌдђCЮЊZnЃЛAЕФЕквЛЕчРыФмНщгкУОКЭСђСНдЊЫижЎМфЃЌAЕЅжЪОЇЬхЕФОЇАћНсЙЙжаAдзггыжмЮЇ4ИідзгаЮГЩе§ЫФУцЬхЃЌЮЊПеМфбгЩьЕФСЂЬхЭјзДНсЙЙЃЌдђAЮЊSiЃЌОнвдЩЯЗжЮіНтД№ЁЃ
![]() ЁЂBЁЂCЮЊдзгађЪ§вРДЮЕндіЕФЧАЫФжмЦкЕФдЊЫиЃЌAЕФЕквЛЕчРыФмНщгкУОКЭСђСНдЊЫижЎМфЃЌAЕЅжЪОЇЬхЕФОЇАћНсЙЙШчЭМ2ЫљЪОЗжЮіПЩжЊЃЌAЮЊЙшаЮГЩЕФОЇЬхЃЌЪєгкдзгОЇЬхЃЌЦфдзгдгЛЏЗНЪНЮЊ
ЁЂBЁЂCЮЊдзгађЪ§вРДЮЕндіЕФЧАЫФжмЦкЕФдЊЫиЃЌAЕФЕквЛЕчРыФмНщгкУОКЭСђСНдЊЫижЎМфЃЌAЕЅжЪОЇЬхЕФОЇАћНсЙЙШчЭМ2ЫљЪОЗжЮіПЩжЊЃЌAЮЊЙшаЮГЩЕФОЇЬхЃЌЪєгкдзгОЇЬхЃЌЦфдзгдгЛЏЗНЪНЮЊ![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃКдзгЃЛsp3ЃЛ
![]() ЕФМлЕчзгХХВМЮЊ
ЕФМлЕчзгХХВМЮЊ![]() ЃЌгаШ§ИіЕчзгВуЃЌЭтВуЮЊ6ИіЕчзгЃЌBЮЊSдзгЃЌCЮЛгкдЊЫижмЦкБэЕФdsЧјЃЌЦфЛљЬЌдзгВЛДцдкВЛГЩЖдЕчзгЃЌХаЖЯЮЊZnдзгЃЌBгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФЛЏбЇЪНЮЊЃКZnSЃЛ
ЃЌгаШ§ИіЕчзгВуЃЌЭтВуЮЊ6ИіЕчзгЃЌBЮЊSдзгЃЌCЮЛгкдЊЫижмЦкБэЕФdsЧјЃЌЦфЛљЬЌдзгВЛДцдкВЛГЩЖдЕчзгЃЌХаЖЯЮЊZnдзгЃЌBгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФЛЏбЇЪНЮЊЃКZnSЃЛ
ЙЪД№АИЮЊЃКZnSЃЛ
![]() BгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФУмЖШЮЊag/cm3ЃЌдђBдзгжЎМфзюНќОрРыЮЊ
BгыCЫљаЮГЩЛЏКЯЮяОЇЬхЕФУмЖШЮЊag/cm3ЃЌдђBдзгжЎМфзюНќОрРыЮЊ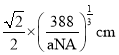 ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК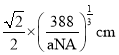 ЁЃ
ЁЃ

 УћаЃПЮЬУЯЕСаД№АИ
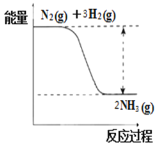
УћаЃПЮЬУЯЕСаД№АИЁОЬтФПЁПЮЊВтЖЈФГПЙЫсвЉжаЬМЫсИЦЙЬЬхЕФДПЖШЃЈСэвЛжжГЩЗжЮЊЕэЗлЃЉЃЌГЦШЁ12.5gДЫвЉЦЌжУгкЩеБжаЃЌМгШыЙ§СПЕФЯЁбЮЫсЃЌВтЕУЗДгІЙ§ГЬжаЩеБКЭвЉЦЗЕФзмжиСПЫцЪБМфЕФБфЛЏЪ§ОнШчЯТЃК
ЗДгІЪБМф/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
ЩеБКЭвЉЦЗЕФзмжи/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
МЦЫуЃК(1)ЙВЪеМЏЕНБъзМзДПіЯТCO2ЕФЬхЛ§____________________ЃЛ
(2)ИУбљЦЗжаЬМЫсИЦЕФжЪСПЗжЪ§________________________ЁЃ
ЁОЬтФПЁПФГЛЏбЇаЁзщвдЛЗМКДМ![]() жЦБИЛЗМКЯЉ.вбжЊЃК
жЦБИЛЗМКЯЉ.вбжЊЃК
УмЖШЃЈg/cm3ЃЉ | ШмЕуЃЈЁцЃЉ | ЗаЕуЃЈЁцЃЉ | ШмНтад | |
ЛЗвбДМ | 0.96 | 25 | 161 | ФмШмгкЫЎ |
ЛЗвбЯЉ | 0.81 | Љ103 | 83 | ФбШмгкЫЎ |
(1)жЦБИДжЦЗНЋ12.5mLЛЗвбДММгШыЪдЙмAжаЃЌдйМгШы1mlХЈСђЫсЃЌвЁдШКѓЗХШыЫщДЩЦЌЃЌЛКТ§МгШШжСЗДгІЭъШЋЃЌдкЪдЙмCФкЕУЕНЛЗвбЯЉДжЦЗЁЃ
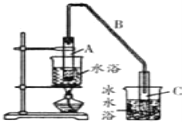
ЂйAжаЫщДЩЦЌЕФзїгУЪЧ_____________ЃЌЕМЙмBГ§СЫЕМЦјЭтЛЙОпгаЕФзїгУЪЧ_______ЁЃ
ЂкаДГіЛЗвбДМжЦБИЛЗвбЯЉЕФЛЏбЇЗДгІЗНГЬЪН___________________________ЁЃ
ЂлЪдЙмCжУгкБљЫЎдЁжаЕФФПЕФЪЧ____________________________ЁЃ
(2)ЛЗвбЯЉДжЦЗжаКЌгаЛЗвбДМКЭЩйСПЫсаддгжЪЕШашвЊЬсДПЁЃ
ЂйМгШыБЅКЭЪГбЮЫЎЃЌеёЕДЁЂОВжУЁЂЗжВуЃЌЫЎдк_______ВуЃЈЬюЩЯЛђЯТЃЉЃЌЗжвККѓгУ_________ЃЈЬюШыБрКХЃЉЯДЕгЁЃ
aЃЎKMnO4ШмвК bЃЎЯЁ H2SO4 cЃЎNa2CO3ШмвК
ЂкдйНЋЛЗвбЯЉШШСѓЃЌеєСѓЪБвЊМгШыЩњЪЏЛвЃЌФПЕФЪЧ_____________________________ЁЃ
ЂлЪеМЏВњЦЗЪБЃЌПижЦЕФЮТЖШгІдк_________зѓгвЁЃ
(3)вдЯТЧјЗжЛЗвбЯЉОЋЦЗКЭДжЦЗЕФЗНЗЈЃЌКЯРэЕФЪЧ_______ЁЃ
aЃЎгУЫсадИпУЬЫсМиШмвК bЃЎгУН№ЪєФЦ cЃЎфхЫЎ