题目内容
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM 2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
⑴ 已知:2SO2(g) + O2(g) ![]() 2SO3(g) △H =﹣196.6kJmol-1
2SO3(g) △H =﹣196.6kJmol-1
2NO(g) + O2(g) ![]() 2NO2(g) △H =﹣113.0kJmol-1
2NO2(g) △H =﹣113.0kJmol-1
则反应NO2(g) + SO2(g) ![]() SO3(g) + NO(g) △H =__________kJmol-1。
SO3(g) + NO(g) △H =__________kJmol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有__________。
a、体系密度保持不变 b、混合气体颜色保持不变
c、SO2和NO的体积比保持不变 d、每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=________________。
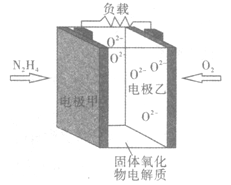
⑵ CO、CO2都可用于合成甲醇。甲醇既是重要的化工原料,又可作为燃料,近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如图1所示,回答下列问题。

① Pt(a)电极是电池的______极,电极反应式为:_________________。
② 如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有________mol。
③ CO用于合成甲醇反应方程式为:CO(g) + 2H2(g)![]() CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
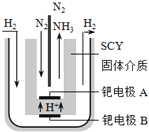
⑶ 图3是一种用NH3脱除烟气中NO的原理。
① 该脱硝原理中,NO最终转化为H2O和__________(填化学式)。
② 当消耗2mol NH3和0.5mol O2时,除去的NO在标准状况下的体积为__________L。
⑷ NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示,写出NO分解的化学方程式______________。
【答案】﹣41.8kJ/mol bc 1.8 负 2CH3OH+2H2O-12e-=2CO2↑+12H+ 1/3 此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本 N2 44.8 L 3NO ![]() N2O + NO2
N2O + NO2
【解析】
(1)①2SO2(g) + O2(g) ![]() 2SO3(g),②2NO(g) + O2(g)
2SO3(g),②2NO(g) + O2(g) ![]() 2NO2(g),根据目标反应方程式,根据盖斯定律,(①-②)/2得出△H=(-196.6kJ·mol-1+113.0kJ·mol-1)/2=-41.8kJ·mol-1;a、组分都是气体,气体质量不变,容器为恒容,因此任何时刻气体密度都不变,因此密度不变,不能说明反应达到平衡,故a不符合题意;
2NO2(g),根据目标反应方程式,根据盖斯定律,(①-②)/2得出△H=(-196.6kJ·mol-1+113.0kJ·mol-1)/2=-41.8kJ·mol-1;a、组分都是气体,气体质量不变,容器为恒容,因此任何时刻气体密度都不变,因此密度不变,不能说明反应达到平衡,故a不符合题意;
b、NO2为红棕色气体,其余气体为无色,因此当气体颜色不再改变,说明反应达到平衡,故b符合题意;
c、SO2是反应物,NO为生成物,因此当SO2和NO的体积比保持不变,说明反应达到平衡,故c符合题意;
d、消耗SO3,生成NO2都是向逆反应方向进行,不能说明反应达到平衡,故d不符合题意;
令NO2的物质的量为1mol,SO2的物质的量为2mol,NO2(g) + SO2(g) ![]() SO3(g) + NO(g)
SO3(g) + NO(g)
起始: 1 2 0 0
变化: x x x x
平衡:1-x 2-x x x
(1-x):(2-x)=1:5,解得x=0.75,四种物质的系数都是1,因此有K=![]() =1.8;
=1.8;
(2)①Pt(a)一极通入CH3OH和H2O,转化成CO2和H2O,C的化合价-2价→+4价,化合价升高,根据原电池工作原理,Pt(a)为负极,其电极反应式为CH3OH+H2O-6e-=CO2↑+6H+;
②根据①电极反应式,通过2mole-,消耗CH3OH物质的量为2mol/6=1/3mol;
③根据图2,此压强下CO的转化率已较高,再增大压强,转化率提高并不大,会增加生产成本;
(3)①根据图3,NH3最终转化为H2O和N2;
②根据转化关系,NH3中N的化合价升高,NO和O2中化合价降低,根据得失电子数目守恒,2mol×[0-(-3)]=0.5mol×2×[0-(-2)]+n(NO)×(2-0),解得n(NH3)=2mol,标准状况下,V(NO)=2mol×22.4L·mol-1=44.8L;
(4)NO分解生成两种化合物,NO为反应物,根据图4,NO的物质的量为3mol,Y和Z为生成物,且物质的量为1mol,根据氮元素守恒,生成物中含有N2O,N的化合价降低,必然有化合价升高,即另一种产物是NO2,因此化学反应方程式为3NO![]() N2O+NO2。
N2O+NO2。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案