题目内容
19.下列排列顺序不正确的是( )| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
分析 A.电子层越多半径越大,电子层相同时原子序数越大半径越小;
B.元素的非金属性越强,对应的最高价氧化物的水化物越强;
C.元素的非金属性越强,对应的氢化物越稳定;
D.同周期元素从左到右元素的金属性逐渐减弱.
解答 解:A.电子层越多半径越大,则O原子半径最小,电子层相同时原子序数越大半径越小,则Na>S,故A正确;
B.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物越强,故B错误;
C.非金属性F>Cl>Br,元素的非金属性越强,对应的氢化物越稳定,故C正确;
D.同周期元素从左到右元素的金属性逐渐减弱,则元素金属性:Na>Mg>Al,故D正确.
故选B.
点评 本题考查元素周期律的递变规律,题目难度中等,注意元素的金属性、非金属性与元素对应的单质、化合物的性质关系.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
10.下列离子方程式书写正确的是( )
| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
7.对H3O+的说法正确的是( )
| A. | O原子采取sp2杂化 | B. | O原子采取sp杂化 | ||
| C. | 离子中存在配位键 | D. | 离子中存在非极性键 |
11.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |


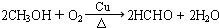 .
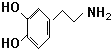
.
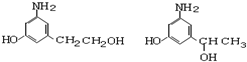 .
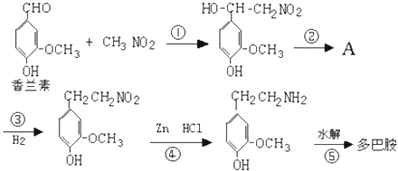
.
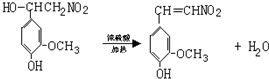 .
. 按要求完成下列各题:
按要求完成下列各题: .H2O的电子式为
.H2O的电子式为 .
.