题目内容
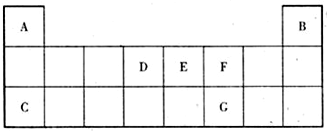
17.下列说法正确的是( )| A. | F是最活泼非金属,Li是最活泼金属 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强 |
分析 A.同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强,同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱;
B、X2+的核外电子数目为18,则X原子核外电子数为18+2=20,故X为Ca;
C、元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18纵行;
D、碱性强弱与溶解性无关.
解答 解:A.同一周期元素,随着原子序数增大,其金属性逐渐减弱,同一主族元素,其金属性随着原子序数增大而增强,所以最活泼金属是Fr,同一周期元素,随着原子序数增大,其非金属性逐渐增强,同一主族元素,其非金属性随着原子序数增大而减弱,所以F是最活泼非金属,故A错误;
B、X2+的核外电子数目为18,则X原子核外电子数为18+2=20,故X为Ca,处于周期表中第四周期第ⅡA族,故B正确;
C.在元素周期表中有7个周期、7个主族、7个副族、1个0族、1个第VIII族,共有7个横行,18个纵行,故C错误;
D、碱性强弱与溶解性无关,所以无因果关系,故D错误;
故选B.
点评 本题考查了元素周期表及元素周期律的应用,明确元素周期表结构及元素周期律内涵即可解答,知道同一周期、同一主族元素性质的递变性,注意离子核外电子数、质子数、电荷数之间的关系,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
7.对H3O+的说法正确的是( )
| A. | O原子采取sp2杂化 | B. | O原子采取sp杂化 | ||
| C. | 离子中存在配位键 | D. | 离子中存在非极性键 |
5.下列每组中各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
12.下列说法中,正确的是( )
| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |
2. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |
6.“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3 | |
| B. | 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O | |
| C. | 制硫酸铜:Cu+2H2SO4=CuSO4+SO2↑+2H2O | |
| D. | 制硫酸铜:2Cu+O2=2CuO CuO+H2SO4(稀)=CuSO4+H2O |
11.下列化学用语正确的是( )
| A. | 硫原子的原子结构示意图: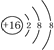 | |
| B. | 过氧化钠的电子式: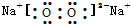 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |