题目内容
2.在如图所示的装置中,a的金属活动性排在氢之前,b为碳棒,关于此装置的各种叙述正确的是( )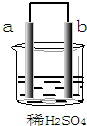
| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
分析 a的金属活动性排在氢之前,b为碳棒,则该装置构成原电池,a为负极失电子发生氧化反应、b为正极氢离子得电子生成氢气发生还原反应,电子从负极沿导线流向正极,据此分析解答.
解答 解:a的金属活动性排在氢之前,b为碳棒,则该装置构成原电池,a为负极、b为正极;
A.b为正极,电极上氢离子得电子发生还原反应,故A正确;
B.通过以上分析知,a是负极、b是正极,故B错误;
C.碳棒b电极上氢离子得电子生成氢气,溶液中氢离子浓度减小,溶液的PH增大,故C错误;
D.该装置构成原电池,所以有电子流动,则从负极a沿导线流向正极b,故D错误;
故选A.
点评 本题考查了原电池原理,明确正负极的判断、电子流向、电极上的反应等知识点即可解答,注意电解质溶液中离子移动方向,为易错点.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
10.下列离子方程式书写正确的是( )
| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
7.对H3O+的说法正确的是( )
| A. | O原子采取sp2杂化 | B. | O原子采取sp杂化 | ||
| C. | 离子中存在配位键 | D. | 离子中存在非极性键 |
11.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
12.下列说法中,正确的是( )
| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |

 .
.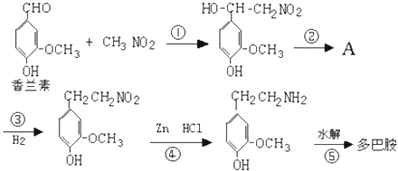
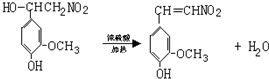 .
.