题目内容
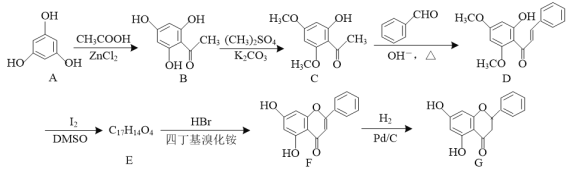
【题目】25℃时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积。下列说法正确的是( )

A.曲线上a、b两点![]() 的值一定相等
的值一定相等
B.pH 相同时,c(HA)>c(HB)
C.当lg![]() =6时,HA溶液的pH=8
=6时,HA溶液的pH=8
D.已知,酸的酸性越强,其对应钠盐的碱性越弱,则25℃时,NaA溶液的pH 一定小于NaB溶液
【答案】AD
【解析】
在25℃下,稀释HA、HB两种酸溶液pH=2,加水稀释至![]() ,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
在25℃下,稀释HA、HB两种酸溶液pH=2,加水稀释至![]() ,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
A.曲线上a、b两点,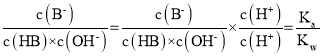 温度不变比值一定不变,所以比值一定相等,故A正确;
温度不变比值一定不变,所以比值一定相等,故A正确;
B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B错误;
C.HA为强酸,lg![]() =6时,稀释106倍,此时需要考虑水的电离,溶液pH接近7,不可能变化为碱,故C错误;
=6时,稀释106倍,此时需要考虑水的电离,溶液pH接近7,不可能变化为碱,故C错误;
D.HA为强酸,HB为弱酸,25℃时,NaA是强酸盐溶液的pH=7,NaB溶液中B离子水解溶液显碱性pH>7,NaA溶液的pH一定小于NaB溶液,故D正确;
故选AD。

【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
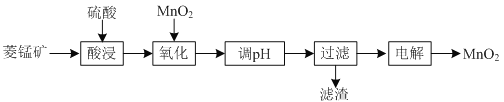
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。