题目内容
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
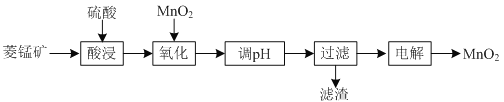
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
【答案】MnCO3+2H+=Mn2++CO2↑ +H2O 提高菱锰矿中锰元素的浸出率![]() 提高菱锰矿的转化率
提高菱锰矿的转化率![]() 抑制
抑制![]() 的水解 升高温度或将菱锰矿粉碎
的水解 升高温度或将菱锰矿粉碎 ![]() 5.0~7.8 1.0×10-32
5.0~7.8 1.0×10-32
【解析】
![]() ,
, ![]() 、
、![]() 溶于硫酸,溶液中阳离子主要是Mn2+、Fe2+、Al3+,结合表中金属离子开始沉淀及沉淀完全时的pH,Fe2+沉淀完全pH是9.7,此时Mn2+已被沉淀部分,降低了MnO2的产率,加入MnO2,目的是使Fe2+被氧化成Fe3+,Fe3+和Al3+沉淀完全时的最低pH为5.0,该情况下Mn2+还未开始沉淀,结合流程可知电解液含Mn2+。
溶于硫酸,溶液中阳离子主要是Mn2+、Fe2+、Al3+,结合表中金属离子开始沉淀及沉淀完全时的pH,Fe2+沉淀完全pH是9.7,此时Mn2+已被沉淀部分,降低了MnO2的产率,加入MnO2,目的是使Fe2+被氧化成Fe3+,Fe3+和Al3+沉淀完全时的最低pH为5.0,该情况下Mn2+还未开始沉淀,结合流程可知电解液含Mn2+。
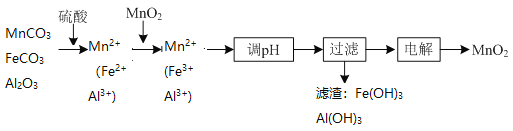
(1)①“酸浸”时MnCO3发生反应的离子方程式: MnCO3+2H+=Mn2++CO2↑ +H2O。
② “酸浸”过程中加入过量硫酸的目的还有:提高菱锰矿中锰元素的浸出率,或者说提高菱锰矿转化率。
③提高“酸浸”的速率,还可以采取的方法:适当升高温度、搅拌、将菱锰矿粉碎增大接触面积、适当增大酸的浓度等。
(2)由流程分析知Fe2+被MnO2氧化,根据氧化还原反应原理确定产物为Fe3+和Mn2+, 离子方程式:![]() 。
。
(3)杂质离子是Fe3+和Al3+ ,“调pH””的目的是使Fe3+和Al3+沉淀完全,pH最小5.0,但又不能使Mn2+开始沉淀,故pH小于7.8, “调pH”的范围应为5.0≤pH<7.8。
(4)当溶液中时Al3+沉淀完全, c(Al3+)≤10-5mol/L,此时pH=5.0,即c(H+)=1×10—5molL—1,c(OH—)=1×10—9molL—1,则Ksp[Al(OH)3] =c(Al3+)×c3(OH—)=![]() 。
。

【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O