题目内容
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
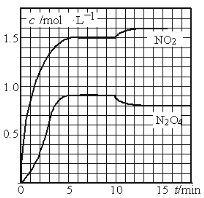
A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
【答案】D
【解析】
试题A、根据图像可知前5min内生成N2O4的浓度是0.9mol/L,则反应的平均速率v(N2O4)=0.9mol/L÷5min=0.18mol·L-1·min-1,A错误;B、T1℃时反应②平衡时N2O4的浓度是0.9mol/L,NO2的浓度是1.5mol/L,则反应②的化学平衡常数K=![]() ,B错误;C、10min后升高并维持容器的温度为T2℃,此时N2O4的浓度降低,NO2的浓度升高,这说明反应②是放热反应。N2O4浓度减少0.2mol/L,但NO2浓度只增加0.1mol/L,这说明反应①升高温度后平衡向逆反应方向进行,即正方应也是放热反应,C错误;D、若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,则根据方程式可知相当于起始时加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,则T1℃达到平衡时,N2O4的物质的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的转化率为10%,D正确,答案选D。
,B错误;C、10min后升高并维持容器的温度为T2℃,此时N2O4的浓度降低,NO2的浓度升高,这说明反应②是放热反应。N2O4浓度减少0.2mol/L,但NO2浓度只增加0.1mol/L,这说明反应①升高温度后平衡向逆反应方向进行,即正方应也是放热反应,C错误;D、若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,则根据方程式可知相当于起始时加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,则T1℃达到平衡时,N2O4的物质的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的转化率为10%,D正确,答案选D。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目