题目内容
12.下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )| A. | C2H2:sp2、直线形 | B. | SO42-:sp3、三角锥形 | ||
| C. | H3O+:sp3、V形 | D. | BF3:sp2、平面三角形 |
分析 根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;
中心原子的杂化类型为sp2,说明该分子中心原子的价层电子对个数是3,无孤电子对数,空间构型是平面三角形;据此判断.
解答 解:A.乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,为直线形结构,故A错误;
B.SO42-中,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb)=4+$\frac{1}{2}$(6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化,分子形状为正四面体形,故B错误;
C.H3O+离子中价层电子对=3+1=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该离子中含有一个孤电子对,所以其空间构型为三角锥型,故C错误;
D.BF3分子中硼原子价层电子对=3+0=3,杂化轨道数为3,所以采取sp2杂化,含孤电子对数为0,所以其空间构型为平面三角形,故D正确;
故选D.
点评 本题考查了原子杂化方式及分子的立体构型的判断,侧重分子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列有机物不会发生水解反应的是( )
| A. | 脂肪 | B. | 蛋白质 | C. | 葡萄糖 | D. | 纤维素 |
1.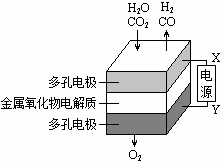 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ CO2+2eˉ=═CO+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
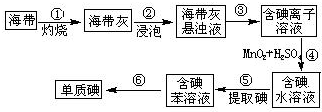 碘在工农业生产和日常生活中有重要用途.
碘在工农业生产和日常生活中有重要用途. 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题. .
.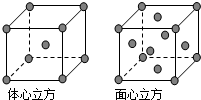 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.