题目内容
19.今有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20,且a+b+c=25; ②元素Z的原子价电子构型为ns2npn+2; ③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物; ④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38:77.回答下列问题:(1)Z的价电子排布图为:
 .
.(2)X2Y2的电子式
 ,该晶体中含微粒间的作用有:离子键和非极性键.
,该晶体中含微粒间的作用有:离子键和非极性键.(3)Y的最常见氢化物的VSEPR模型为四面体,其中Y原子以sp3杂化轨道成键;Z的氯化物的分子空间构型是正四面体;根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是2个 σ 键、2 个π 键.
分析 元素Y的原子价电子排布为ns2npn+2,则Y的价电子排布可能为2s22p4或3s23p5,为O元素或Cl元素;
X和Y在不同条件下可形成X2Y和X2Y2两种固态化合物,应为Na2O或Na2O2,所以X为Na元素,Y为O元素;又三者原子序数之和为25,则Z的原子序数为25-11-8=6,应为C元素,O和C在不同条件下可形成CO和CO2两种气态化合物,元素C的硫化物与元素C的氯化物,常温下均为液态,分别为CS2和CCl4,且二者的相对分子质量之比为76:154=38:77,验证符合,结合元素对应的单质、化合物的性质解答该题.
解答 解:(1)Z是碳,碳原子的价电子排布图为: ,故答案为:
,故答案为: ;
;
(2)X2Y2是过氧化钠,其电子式为: ,过氧化钠中钠离子与过氧根离子之间存在离子键,过氧根离子中氧与氧是非极性共价键,故答案为:
,过氧化钠中钠离子与过氧根离子之间存在离子键,过氧根离子中氧与氧是非极性共价键,故答案为: ;离子键和非极性键;
;离子键和非极性键;
(3)Y为O元素,常见氢化物为水,形成2个σ键,孤电子对数为6−2×12=2,可价层电子对为2+2=4,VSEPR模型是四面体,所以Y原子以sp3杂化,四氯化碳中碳是sp3杂化,分子空间构型是正四面体,CS2是直线型分子,结构与二氧化碳相似,所以分子中含有2个 σ 键、2 个π 键,故答案为:四面体;sp3;正四面体;2个 σ 键、2 个π 键.
点评 本题考查结构性质位置关系、晶体结构与化学键、杂化轨道、分子结构等,难度不大,注意利用元素化合物的特点,先进行猜测再验证推断元素.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
5.下列关于几种仪器使用的第一步的说法中,错误的是( )
| A. | 托盘天平使用前应先调“零” | |
| B. | 容量瓶使用前应先检查是否漏水 | |
| C. | 分液漏斗使用前应先检验气密性 | |
| D. | 酒精灯在使用前应先检查灯芯是否有结焦现象 |
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.则这三种元素所组成的化合物的分子式不可能是( )
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
4.下列实验不能达到目的是( )
| A. | 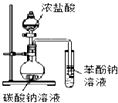 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. | 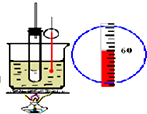 如图实验室制硝基苯 | |
| C. | 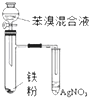 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 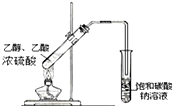 如图实验室制乙酸乙酯 |
9.下列反应中,水只作氧化剂的是( )
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
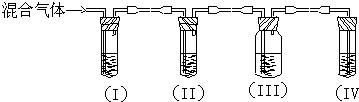
 、
、 、
、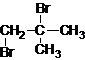 .
. .
.
 .(不用注明条件)
.(不用注明条件)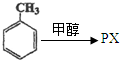
 .(不用注明条件)
.(不用注明条件) .
.