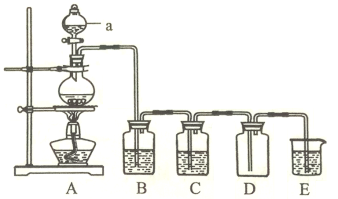
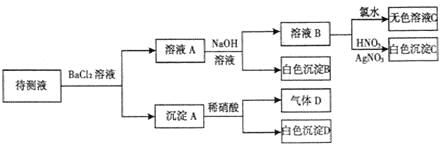
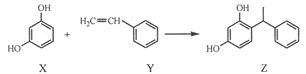
题目内容
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
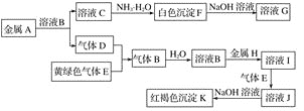
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
【答案】H2 FeCl2 ![]()
![]() 产生白色沉淀,迅速变成灰绿色最后变成红褐色
产生白色沉淀,迅速变成灰绿色最后变成红褐色
【解析】
黄绿色气体E为Cl2,红褐色沉淀K为Fe(OH)3,金属H与溶液B反应得到I,I能被氯气氧化得到J,J与氢氧化钠反应得Fe(OH)3,可推知H为Fe、B为盐酸、I为FeCl2,J为FeCl3,故B为HCl、气体单质D为H2,金属A与盐酸反应得到C为盐,能与氨气反应得到白色沉淀F,且白色沉淀F溶于氢氧化钠溶液得到G,可推知A为Al、C为AlCl3、F为Al(OH)3、G为NaAlO2,据此解答。
(1)由上述分析可知,D为H2,I为FeCl2,
故答案为:H2;FeCl2;
(2)C为AlCl3,其与NH3·H2O反应生成氢氧化铝和氯化铵,其离子反应方程式为:![]() ;
;
故答案为:![]() ;
;
(3)J为FeCl3,其与NaOH溶液反应生成氢氧化铁和氯化钠,其离子反应方程式为:![]() ,
,
故答案为:![]() ;
;
(4)I为FeCl2,其与NaOH溶液反应会生成氢氧化亚铁,氢氧化亚铁极易被空气氧化而生成氢氧化铁,其现象为:产生白色沉淀,迅速变成灰绿色最后变成红褐色,
故答案为:产生白色沉淀,迅速变成灰绿色最后变成红褐色。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
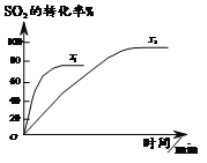
单元期中期末卷系列答案【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
完成下列填空:
(1)T1__________(选填“>”“<”或“=”)T2,判断依据是_______________;该反应为___________(选填“放”或“吸”)热反应,判断依据是__________。
(2)下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | ① | ② | ③ | ④ |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
②对应的投料比为_____。投料比为8:10时,平衡混合气体中SO3体积分数为______。
(3)在相同温度下:2NO(g)+O2(g)![]() 2NO2(g) K1=a;NO2(g)+SO2(g)
2NO2(g) K1=a;NO2(g)+SO2(g)![]() SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)
SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)![]() 2SO3(g) 的平衡常数K=__________(用a、b表示)。
2SO3(g) 的平衡常数K=__________(用a、b表示)。
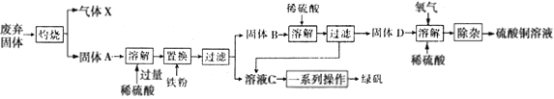
(4)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

吸收池中发生反应的离子方程式是________;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为_________。