题目内容
【题目】氯的化合物与人们的生活紧密相关。回答下列问题:
(1)高血压患者,应该减少食盐的摄入量,为了“减盐不减咸”,建议高血压患者食用低钠盐(含氯化钾30%左右的氯化钠)。我们可以通过________________(操作名称)来检验食盐中含有钾元素,得到食盐中含钾元素的实验依据是___________。
(2)瑞典化学家舍勒(Carl Wilhelm Scheele)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首次制得了氯气。实验室用下图所示装置制取纯净的氯气。
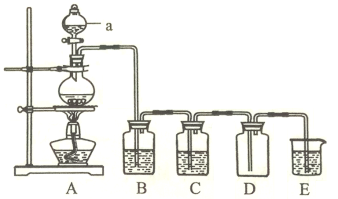
①仪器a的名称为______________。
②装置A中发生反应的离子方程式为_____________________________。
③装置B的作用是_____________,装置C中的试剂为_____________。
④装置E中发生反应的离子方程式为__________________。
⑤当有4molHCl被氧化时,产生的氯气在标准状况下的体积为__________L。
(3)漂白液(有效成分是NaClO)与洁厕灵(主要成分为盐酸)混合,也会产生Cl2,请写出该反应的离子方程式__________。
【答案】焰色反应 透过蓝色钴玻璃观察火焰颜色呈紫色 分液漏斗 MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的HCl气体 浓硫酸 Cl2+2OH-=Cl-+ ClO-+2H2O 44.8 Cl-+ ClO-+2H+= Cl2↑+H2O
Mn2++Cl2↑+2H2O 除去氯气中的HCl气体 浓硫酸 Cl2+2OH-=Cl-+ ClO-+2H2O 44.8 Cl-+ ClO-+2H+= Cl2↑+H2O
【解析】
根据焰色反应的原理分析解答;根据氯气的实验室制备原理及装置图分析装置的名称、作用及发生的相关反应;根据氯气的化学性质书写相关离子方程式。
(1)钾元素的检验可以用焰色反应来检验,实验现象是透过蓝色钴玻璃观察火焰颜色呈紫色,故答案为:焰色反应;透过蓝色钴玻璃观察火焰颜色呈紫色;
(2)①如图所示,a为分液漏斗;
②装置A为氯气的发生装置,其中反应为二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
③由图示装置及实验目的分析知,B、C装置是除杂装置,则B的目的是除去氯气中的HCl气体,C装置是干燥装置,C中试剂为浓硫酸;
④装置E是尾气处理装置,氯气通入氢氧化钠溶液中,反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ ClO-+2H2O;
⑤反应中HCl未全部被氧化,被氧化的部分生成Cl2,则n(Cl2)=1/2n(HCl)=1/2×4mol=2mol,V(Cl2)=22.4L/mol×2mol=44.8L;
故答案为:分液漏斗;MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O;除去氯气中的HCl气体、浓硫酸;Cl2+2OH-=Cl-+ ClO-+2H2O;44.8;
Mn2++Cl2↑+2H2O;除去氯气中的HCl气体、浓硫酸;Cl2+2OH-=Cl-+ ClO-+2H2O;44.8;
(3)次氯酸钠有强氧化性,在酸性条件下可以将盐酸氧化生成氯气,离子方程式为:Cl-+ ClO-+2H+= Cl2↑+H2O,故答案为:Cl-+ ClO-+2H+= Cl2↑+H2O。

 一课一练课时达标系列答案
一课一练课时达标系列答案