��Ŀ����
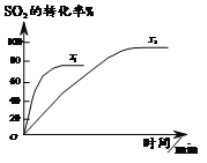
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g)����ͼΪ��ͬ�¶ȣ�T1��T2����SO2��ת������ʱ��ı仯���ߡ�
2SO3(g)����ͼΪ��ͬ�¶ȣ�T1��T2����SO2��ת������ʱ��ı仯���ߡ�
���������գ�
(1)T1__________��ѡ�>����<����=����T2���ж�������_______________���÷�ӦΪ___________��ѡ��š����������ȷ�Ӧ���ж�������__________��
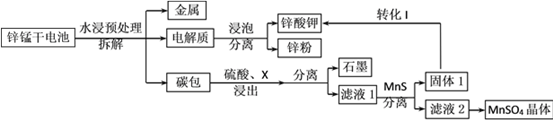
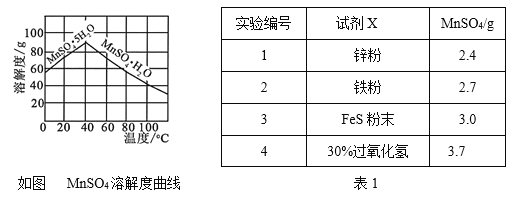
(2)�±�Ϊһ���¶Ⱥ�ѹǿ�£�4��Ͷ�ϱ�[n(SO2):n(O2)]�ֱ�Ϊ2:18��4:15��7:11��8:10ʱSO2��ƽ��ת���ʡ�
Ͷ�ϱ� | �� | �� | �� | �� |
SO2ƽ��ת���ʣ�% | 97.1 | 96.8 | 95.8 | 90.0 |
�ڶ�Ӧ��Ͷ�ϱ�Ϊ_____��Ͷ�ϱ�Ϊ8:10ʱ��ƽ����������SO3�������Ϊ______��
(3)����ͬ�¶��£�2NO(g)+O2(g)![]() 2NO2(g) K1=a��NO2(g)+SO2(g)
2NO2(g) K1=a��NO2(g)+SO2(g)![]() SO3(g)+NO(g) K2=b����2SO2(g)+O2(g)
SO3(g)+NO(g) K2=b����2SO2(g)+O2(g)![]() 2SO3(g) ��ƽ�ⳣ��K=__________����a��b��ʾ����
2SO3(g) ��ƽ�ⳣ��K=__________����a��b��ʾ����
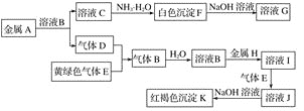
(4)�Ƽ�ѭ�����������᳧β���е�SO2������ת��Ϊ����Ĺ������£�

���ճ��з�����Ӧ�����ӷ���ʽ��________��NaHSO3��Һ�������ԣ�NaHSO3��Һ������Ũ���ɴ�С����Ϊ_________��
���𰸡�> �����������䣬��ͼ��֪T1��T2�ﵽƽ������ʱ��̣�˵��T1��Ӧ�ٶȿ죬����T1�¶ȸ� �� ��ͼ��֪��T1�¶ȸߣ���������ƽ��ת���ʵͣ�˵���¶�����ʱƽ�����ƣ��淴ӦΪ���ȣ�����ӦΪ���� 4:15 50% ab2 SO2+SO32-+H2O��2HSO3- c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)
��������
��1���¶�Խ�ߣ���Ӧ����Խ�죬�ﵽ��ѧƽ���ʱ��Խ�̣��¶����ߣ�ƽ�������ȷ����ƶ���
��2��ͬһ��ѧ��Ӧ������һ�ַ�Ӧ��Ũ�ȿ������������Ӧ��ת���ʣ���������ʽ����ɵã�
��3�����ø�˹���ɵõ���Ӧ֮��Ĺ�ϵ���ɴ˼���ƽ�ⳣ����
��4�����ճ�������������Һ���������Ӧ�������������ƣ�NaHSO3��Һ�������ԣ�˵��HSO3-�ĵ������ˮ�⡣
��1���¶�Խ�ߣ���Ӧ����Խ�죬�ﵽ��ѧƽ���ʱ��Խ�̣���ͼ��֪����ͬ�����£�T1��T2�ﵽƽ������ʱ��̣�˵��T1��Ӧ�ٶȿ죬��T1��T2���¶����ߣ�ƽ�������ȷ����ƶ�����T2��T1�� SO2��ת���ʼ�С��ƽ���������ƶ�����������Ϊ���ȷ�Ӧ���ʴ�Ϊ�����������������䣬��ͼ��֪T1��T2�ﵽƽ������ʱ��̣�˵��T1��Ӧ�ٶȿ죬����T1�¶ȸߣ��ţ���ͼ��֪��T1�¶ȸߣ���������ƽ��ת���ʵͣ�˵���¶�����ʱƽ�����ƣ��淴ӦΪ���ȣ�����ӦΪ���ȣ�
��2��ͬһ��ѧ��Ӧ������һ�ַ�Ӧ��Ũ�ȿ������������Ӧ��ת���ʣ�Ͷ�ϱ�[n��SO2����n��O2��]ԽС��������Ũ��Խ��������ת����Խ�����ݢڵ�ת���ʿ�֪��Ͷ�ϱ�[n��SO2����n��O2��]Ϊ4��15��Ͷ�ϱ�[n��SO2����n��O2��]Ϊ8��10ʱ�����������ת����Ϊ90%������ʼ��������Ϊ4mol���������ʵ���Ϊ5mol�������⽨����������ʽ��

��ƽ��������������������������Ϊ![]() ��100%=50%���ʴ�Ϊ��4��15��50%��
��100%=50%���ʴ�Ϊ��4��15��50%��
��3������֪��Ӧ���α��Ϊ�٢ڣ��ɸ�˹���ɿ�֪��+����2�ɵ�2SO2(g)+O2(g)![]() 2SO3(g)����ƽ�ⳣ��K=K1��K22= ab2���ʴ�Ϊ��ab2��
2SO3(g)����ƽ�ⳣ��K=K1��K22= ab2���ʴ�Ϊ��ab2��
��4�����ճ�������������Һ���������Ӧ�������������ƣ���Ӧ�����ӷ���ʽ��SO2+SO32-+H2O=2HSO3-��NaHSO3��Һ�������ԣ�˵��HSO3-�ĵ������ˮ�⣬��NaHSO3��Һ������Ũ���ɴ�С����Ϊc(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)���ʴ�Ϊ��SO2+SO32-+H2O=2HSO3-��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�