题目内容
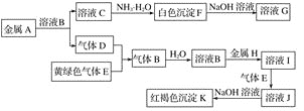
【题目】对于如图所示原电池装置描述,下列说法正确的是( )
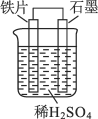
A. 石墨电极作正极
B. 铁片上的反应:Fe -3e- =Fe3+
C. 铁电极附近溶液中氢离子浓度增大
D. 电子由石墨电极通过导线流向铁电极
【答案】A
【解析】
在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,负极上铁失去电子发生氧化反应,石墨作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答。
A. 在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,石墨作正极,A项正确;
B. 铁片作负极,铁失去电子发生氧化反应,电极反应式为:Fe - 2e- = Fe2+, B项错误;
C. 石墨作正极,氢离子移向正极,在石墨上得电子发生还原反应,则铁电极附近溶液中氢离子移向正极,浓度减小,C项错误;
D. 电子从负极沿导线流向正极,即从铁电极流向石墨电极,D项错误;
答案选A。

练习册系列答案
相关题目