题目内容
【题目】某待测溶液(阳离子为Na+)中只可能含有SO42-、SO32-、Cl-、Br-、NO3-、HCO3-中的一种或若干种,进行下列实验(每次实验所加试剂均足量):回答下列问题:
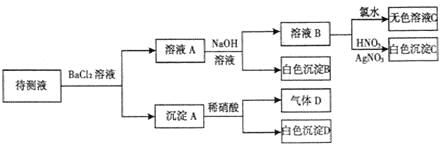
(1)待测液中是否含SO42-、SO32-离子__________________________________________
(2)气体D的化学式为____________,反应生成沉淀B的离子方程式为:____________
(3)根据以上实验,待测液中肯定没有的离子__________________________;肯定存在的离子是_____________________。
【答案】一定有 SO32-,而 SO42- 可能存在可能不存在 NO HCO3-+Ba2++OH-= BaCO3↓+H2O Br- HCO3-、SO32-
【解析】
待测液与氯化钡溶液反应生成沉淀A,则溶液中可能含有SO32-、SO42-,向沉淀中加入稀硝酸生成气体D,白色沉淀D,因为亚硫酸钡具有还原性,能够与硝酸反应生成硫酸钡和一氧化氮气体,而硫酸钡不溶于硝酸,所以溶液中一定存在SO32-,可能存在SO42-;滤液A中加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3-,白色沉淀B为BaCO3;滤液B中加入氯水,得无色溶液,溶液中一定不存在Br-;滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl-,因为加入氯化钡溶液,不能确定原溶液中是否含有Cl-;据以上分析解答。
待测液与氯化钡溶液反应生成沉淀A,则溶液中可能含有SO32-、SO42-,向沉淀中加入稀硝酸生成气体D,白色沉淀D,因为亚硫酸钡具有还原性,能够与硝酸反应生成硫酸钡和一氧化氮气体,而硫酸钡不溶于硝酸,所以溶液中一定存在SO32-,可能存在SO42-;滤液A中加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3-,白色沉淀B为BaCO3;滤液B中加入氯水,得无色溶液,溶液中一定不存在Br-;滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl-,因为加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)根据以上分析可以知道, 待测液中一定有 SO32-,而 SO42-可能存在可能不存在;
答案是: 一定有 SO32-,而 SO42-可能存在可能不存在;
(2)根据分析可以知道,气体D的化学式为NO;碳酸氢根离子与钡离子、氢氧根离子生成碳酸钡,反应生成沉淀B的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
答案是: NO;HCO3-+Ba2++OH-= BaCO3↓+H2O;
(3)根据分析可以知道,待测液中一定不存在的离子为Br-;肯定存在的离子为: HCO3-、SO32-;
答案是: Br-;HCO3-、SO32-。

 阅读快车系列答案
阅读快车系列答案