题目内容
16.纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:方案一:纯碱样品$\stackrel{加热}{→}$测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热一冷却一称量”操作多次,其目的是加热至恒重,以保证NaHCO3全部分解.
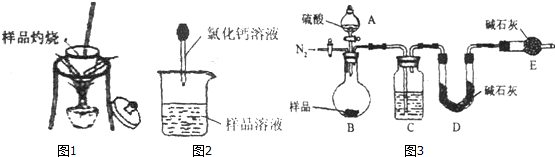
方案二:纯碱样品溶液$\stackrel{氧化钙溶液}{→}$测定沉淀质量
(3)称取m 1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如下图),沉淀完全后,讲混和物进行的后续两步操作分别是用蒸馏水洗涤和干燥.
(4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为$\frac{106{m}_{2}}{{m}_{1}}$%
(5)如果用过量的氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际不变(填“偏高”、“偏低”或“不变”).所涉及的离子反应方程式为:CO32-+Ca2+=CaCO3↓,HCO3-+Ca2++OH-=CaCO3↓+H2O.
方案三:纯碱样品$\stackrel{硫酸}{→}$测定生成CO2的质量
(6)本实验采用图3装置,实验中进行的第一步操作名称是:检查装置气密性,C中盛放的物质是浓硫酸
(7)反应前后都要通入N2,反应后通入N2的目的是排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
(8)要确定纯碱样品的纯度,除了样品的质量外,实验还需要获取的数据是:装置D反应前后质量.
分析 方案一:(1)该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)从而根据残留的固体的量推算出样品中碳酸钠的质量分数.该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
方案二:该方案原理为在样品中加入CaCl2溶液,其中Na2CO3可与CaCl2发生反应Na2CO3+CaCl2=CaCO3↓+2NaCl,而NaHCO3与CaCl2则不反应.从而根据产生的沉淀量,得出纯碱的质量分数.方案关键是测定CaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
(3)沉淀会附着氯化钠、氯化钙需要洗涤.
(4)根据碳酸钙计算碳酸钠质量,再根据质量分数定义计算碳酸钠质量分数.
(5)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,就可得出纯碱的质量分数.
方案三:该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量.
(6)本实验采用图3装置,实验中进行的第一步操作名称是检查装置是否漏气,C装置干燥二氧化碳.
(7)实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差;
(8)要确定纯碱样品的纯度,除了样品的质量外,还需要测定生成CO2的质量;
解答 解:方案一:
(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
故答案为:加热至恒重,以保证NaHCO3全部分解;
方案二:
(3)碳酸钙沉淀会附着氯化钠、氯化钙,过滤后需用蒸馏水洗涤,干燥.
故答案为:用蒸馏水洗涤,干燥;
(4)沉淀经干燥后称量为m2g,碳酸钙物质的量等于碳酸钠物质的量,所以碳酸钠的质量为$\frac{{m}_{2}}{100}$×106g,则该样品中碳酸钠的质量分数为$\frac{\frac{{m}_{2}}{100}×106}{{m}_{1}}$×100%=$\frac{106{m}_{2}}{{m}_{1}}$%.
故答案为:$\frac{106{m}_{2}}{{m}_{1}}$%.
(5)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,可以计算碳酸钠质量,就可得出纯碱的质量分数.故用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数不变,所涉及的离子反应方程式为:CO32-+Ca2+=CaCO3↓,HCO3-+Ca2++OH-=CaCO3↓+H2O,
故答案为:不变,CO32-+Ca2+=CaCO3↓,HCO3-+Ca2++OH-=CaCO3↓+H2O;
方案三:
(6)本实验采用图3装置,实验中进行的第一步操作名称是检查装置气密性,C装置干燥二氧化碳,所以C中盛放的物质是浓硫酸;
故答案为:检查装置气密性,浓硫酸;
(7)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收;
(8)测定生成CO2的质量是测定装置D反应前后质量变化得到二氧化碳质量,
故答案为:装置D反应前后质量;
点评 本题考查了以实验探究“工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数”为载体,对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.

 阅读快车系列答案
阅读快车系列答案| A. | Cu(OH) 2 | B. | Cu | C. | CuSO4 | D. | CuO |
①1,3一丁二烯与溴水的加成产物,
②乙二醇与乙酸酯化得酯,
③甘氨酸与丙氨酸生成二肽,
④苯酚和浓溴水.反应所生成的有机物的种类由多到少的顺序是( )
| A. | ④③②① | B. | ①②③④ | C. | ③①②④ | D. | ③②①④ |
| A. | 豆浆 | B. | 牛奶 | C. | 食盐溶液 | D. | 烟、云、雾 |
| A. | 分散质直径介于1 nm-100 nm之间的分散系称为胶体 | |
| B. | Fe(OH)3难溶于水,因此不可能均匀分散在水里形成稳定的红褐色的液体 | |
| C. | 氢氧化铁胶体粒子在电泳实验中向阴极移动,是因为氢氧化铁胶体粒子带负电 | |
| D. | 胶体粒子是很多分子的集合体,因此都很不稳定,容易聚沉 |
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.
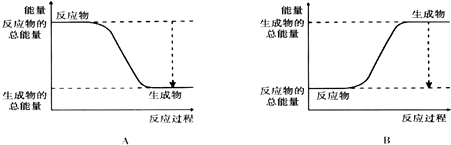
(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||