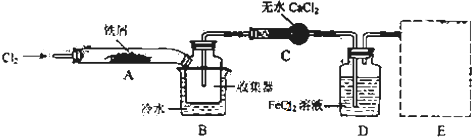
题目内容
8.在下图装置中,装置A的烧瓶中发生的反应的化学方程式为Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,装置C的直玻管中发生的反应的化学方程式为2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3,在装置D的U形管中有无色晶体生成,此晶体的化学式是SO3,装置E中NaOH的作用是吸收尾气,反应的离子方程式为SO2+2OH-═SO32-+2H2O,由于SO2转化为SO3的反应是可逆反应,所以从装置E中排出的气体还应当含有O2(填化学式).事实上,B装置还可以用来控制进入C装置直玻管的反应物的用量,你认为控制的原理是与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1.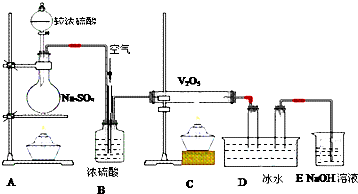
分析 由图可知,A中发生Na2SO3+H2SO4═Na2SO4+H2O+SO2↑可制取二氧化硫,B中浓硫酸干燥气体,在C中发生2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3,D中冷却得到晶体为SO3,最后E中NaOH溶液吸收尾气,以此来解答.
解答 解:由图可知,A中发生Na2SO3+H2SO4═Na2SO4+H2O+SO2↑可制取二氧化硫,B中浓硫酸干燥气体,在C中发生2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3,D中冷却得到晶体为SO3,最后E中NaOH溶液吸收尾气,防止污染环境,发生的离子反应为SO2+2OH-═SO32-+2H2O,由于SO2转化为SO3的反应是可逆反应,所以从装置E中排出的气体还应当含有O2.事实上,B装置还可以用来控制进入C装置直玻管的反应物的用量,控制的原理是与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1,
故答案为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3;SO3;吸收尾气;SO2+2OH-═SO32-+2H2O;O2;与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1.
点评 本题考查物质的制备实验及性质实验,为高频考点,把握气体的制备原理及性质、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.用于解释下列现象的化学用语表述正确的是( )
| A. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| B. | 亚硫酸溶液呈酸性:H2SO3═2H++SO32- | |
| C. | FeCl3溶液呈酸性:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | 氯化铝溶液跟过量的氨水反应:Al3++4OH-═AlO2-+2H2O |
3.30mL0.1mol•L-1的Na2SO3溶液恰好将2×10-3molXO4-还原,则在还原产物中,X元素的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
13.已知氢硫酸中存在平衡H2S?H++HS-,HS-?H++S2-,下列措施会导致平衡向右移动,且C(H+)减小的是( )
| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |
20.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品 试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等.
仪器:①试管,②滴管,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
(4)实验结论同周期元素,从左到右,金属性逐渐减弱,非金属性逐渐增强.
(5)请用原子结构的知识简单解释上述结论同周期元素,从左到右,核电荷数依次增大,原子半径依次减小.原子失电子的能力依次减弱,得电子的能力依次增强.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向移动,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品 试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等.
仪器:①试管,②滴管,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
| 实验内容 | 实验现象 | 化学方程式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | ||
| ⑥ |
(5)请用原子结构的知识简单解释上述结论同周期元素,从左到右,核电荷数依次增大,原子半径依次减小.原子失电子的能力依次减弱,得电子的能力依次增强.
17.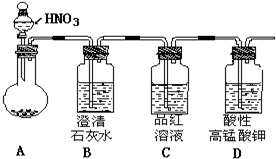 某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
(1)提出合理假设
假设一:该白色粉末成分为碳酸钠
假设二:该白色粉末成分为亚硫酸钠
假设三:该白色粉末成分为碳酸钠和亚硫酸钠的混合物
(2)将上述实验方案存在的主要错误和后果填在下表中(可不填满,也可补充)
(3)修正上述方案并完成探究实验,填写相应的实验现象
(4)下列试剂中能替代酸性高锰酸钾,澄清石灰水的是B
A.氢氧化钠溶液、氢氧化钡溶液 B.碘淀粉溶液,硅酸钠溶液
C.含酚酞的氨水、紫色石蕊试液 D.溴水、硝酸钡溶液
(5)实验过程中发现溶液不能顺利滴入烧瓶,请提出改进建议分液漏斗换成恒压分液漏斗.
 某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)(1)提出合理假设
假设一:该白色粉末成分为碳酸钠
假设二:该白色粉末成分为亚硫酸钠
假设三:该白色粉末成分为碳酸钠和亚硫酸钠的混合物
(2)将上述实验方案存在的主要错误和后果填在下表中(可不填满,也可补充)
| 错误 | 后果 |
| 假设编号 | 相应现象 |
| 假设一 | |
| 假设二 | |
| 假设三 |
A.氢氧化钠溶液、氢氧化钡溶液 B.碘淀粉溶液,硅酸钠溶液
C.含酚酞的氨水、紫色石蕊试液 D.溴水、硝酸钡溶液
(5)实验过程中发现溶液不能顺利滴入烧瓶,请提出改进建议分液漏斗换成恒压分液漏斗.