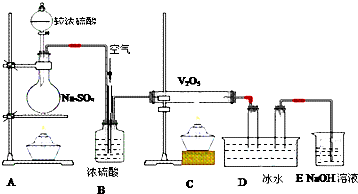
题目内容
3.30mL0.1mol•L-1的Na2SO3溶液恰好将2×10-3molXO4-还原,则在还原产物中,X元素的化合价是( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 根据氧化还原反应中得失电子守恒:化合价升高值=化合价降低值来计算.
解答 解:该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒得电子数$\frac{0.006mol}{0.002mol}$=3,可见X元素化合价变化为3,即从+7价降到+4价.
故选D.
点评 本题考查学生氧化还原反应中的电子守恒思想的应用知识,侧重于基础知识的考查,注意从电子转移的角度分析,难度不大.

练习册系列答案
相关题目
13. 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
①取上层液体放在另一试管Q中,向Q中加水,若不分层则上层是水
②向试管中加溴水,振荡静置后呈仍为无色的是水层
③直接向试管中加水,振荡,高度增加的液体层是水层
④向试管中加酒精,高度增加的液体层是有机层.
 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )①取上层液体放在另一试管Q中,向Q中加水,若不分层则上层是水
②向试管中加溴水,振荡静置后呈仍为无色的是水层
③直接向试管中加水,振荡,高度增加的液体层是水层
④向试管中加酒精,高度增加的液体层是有机层.
| A. | ①③ | B. | ①②③ | C. | ②④ | D. | ①②③④ |
11.下列各组中的两种物质,能用淀粉碘化钾试纸检验的是( )
| A. | 溴水和碘水 | B. | 盐酸和稀硫酸 | C. | 溴水和稀HCl | D. | 浓HNO3和氯水 |
18.由反应:2FeCl3+Cu→2FeCl2+CuCl2 推断出的氧化性或还原性强弱的结论,正确的是( )
| A. | 氧化性 Cu2+>Fe2+ | B. | 氧化性 Fe3+>Cu2+ | ||
| C. | 还原性 Fe2+>Cu | D. | 还原性 Fe>Cu |
12.化学与生活密切相关,下列不正确的是( )
| A. | 聚乙烯是无毒高分子,用作食品包装袋 | |
| B. | 石油的干馏得到汽油、柴油、煤油 | |
| C. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| D. | 王水是由浓盐酸和浓硝酸按3:1混合 |
5.1,2-二溴乙烷可作汽油抗爆剂的添加剂,下图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
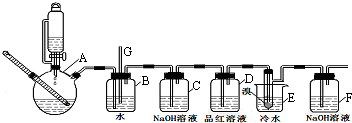
有关数据列表如下:
请按要求回答下列问题:
(1)实验开始之前必要的操作是检查装置的气密性.
(2)仪器A的名称为三颈瓶.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)实验开始之前必要的操作是检查装置的气密性.
(2)仪器A的名称为三颈瓶.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).