题目内容
13.已知氢硫酸中存在平衡H2S?H++HS-,HS-?H++S2-,下列措施会导致平衡向右移动,且C(H+)减小的是( )| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |
分析 根据题意知,加入的物质和氢离子反应才能使电离平衡向右移动且c(H+)减小,据此分析解答.
解答 解:A、加入NaCl对氢硫酸的电离平衡无影响,故A错误;
B、加入NaOH,能够反应氢离子,使氢离子浓度减小,平衡正向移动,故B正确;
C、加入硫酸铜固体,铜离子能够与硫离子反应生成CuS沉淀,平衡正向移动,氢离子浓度增大,故C错误;
D、加入硫化钠,硫离子浓度增大,平衡逆向移动,故D错误;
故选B.
点评 本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
3.下列说法正确的是[( )].
| A. | 某温度时,1LpH=6的水溶液,含10-6mol OH-离子 | |
| B. | 含10.6gNa2CO3溶液中,所含阴离子总数等于0.1 mol | |
| C. | V L a mol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3 mol | |
| D. | 电解精炼粗铜时,每转移1mol电子,阳极上溶解的Cu原子数必为0.5mol |
4.下列各组物质中只用水就能鉴别的是( )
| A. | 苯、乙酸、四氯化碳 | B. | 乙醇、乙醛、乙酸 | ||
| C. | 乙醛、乙二醇、硝基苯 | D. | 苯酚、乙醇、甘油 |
1.已知在酸性条件下有以下反应关系KBrO3 能将KI氧化成I2 或KIO3,其本身被还原为Br2,Br2 能将I-氧化为I2;KIO3 能将 I- 氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2.现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得产物也不同.
(1)试将讨论的结果填入表中:
(2)此表编号③中,当 n(I2)=n(IO3-) 时,a 的值为$\frac{8}{15}$.
(1)试将讨论的结果填入表中:
| 编 号 | а取值范围 | 产物化学式(离子符号) |
| ① | I2、Br- | |
| ② | $\frac{1}{6}$<а<1/5 | |
| ③ | I2、IO3-、Br2 | |
| ④ |
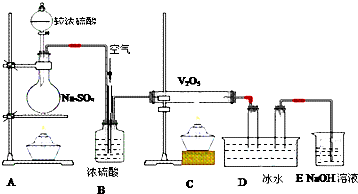
15.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.
已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:

已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |