题目内容
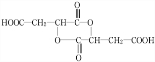
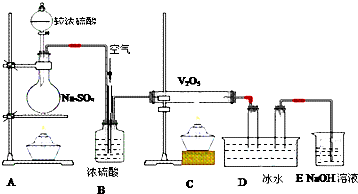
17. 某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)(1)提出合理假设
假设一:该白色粉末成分为碳酸钠
假设二:该白色粉末成分为亚硫酸钠
假设三:该白色粉末成分为碳酸钠和亚硫酸钠的混合物
(2)将上述实验方案存在的主要错误和后果填在下表中(可不填满,也可补充)
| 错误 | 后果 |
| 假设编号 | 相应现象 |
| 假设一 | |
| 假设二 | |
| 假设三 |
A.氢氧化钠溶液、氢氧化钡溶液 B.碘淀粉溶液,硅酸钠溶液
C.含酚酞的氨水、紫色石蕊试液 D.溴水、硝酸钡溶液
(5)实验过程中发现溶液不能顺利滴入烧瓶,请提出改进建议分液漏斗换成恒压分液漏斗.
分析 (1)根据“某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成”提出可能的第三种假设情况;
(2)硝酸具有氧化性,能够将亚硫酸钠氧化成硫酸钠;同时检验二氧化硫和二氧化碳时,应该先检验二氧化硫,完全除去二氧化硫后再检验二氧化碳;
(3)假设1通过检验是否生成二氧化碳气体判断是否存在碳酸钠,
假设2利用二氧化硫的漂白性检验是否存在亚使硫酸钠;
假设3品红试液褪色,用高锰酸钾溶液除去二氧化硫后,通入澄清石灰水变浑浊证明含有碳酸钠;
(4)根据该实验中酸性高锰酸钾溶液、澄清石灰水的作用进行判断;
(5)分液漏斗中的液体滴入圆底烧瓶后,烧瓶中压强增大,导致溶液不能顺利滴入烧瓶,可用分液漏斗换成恒压分液漏斗.
解答 解:(1)某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成,所以可能的情况有三种:该白色粉末成分为亚硫酸钠、该白色粉末成分为碳酸钠、该白色粉末成分为碳酸钠和亚硫酸钠的混合物,依据假设1:该白色粉末成分为碳酸钠;假设2:该白色粉末成分为亚硫酸钠;得到假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物,
故答案为:该白色粉末成分为碳酸钠和亚硫酸钠的混合物;
(2)由于硝酸能将亚硫酸钠氧化,不能检验是否存在亚硫酸钠,所以反应物不能用硝酸;
二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,装置连接顺序错误,无法检验样品是否存在碳酸钠和亚硫酸钠,
故答案为:
| 错误 | 后果 |
| 不能用硝酸作反应物 | 硝酸能将亚硫酸钠氧化,不能检验是否存在亚硫酸钠 |
| 装置连接顺序错误 | 无法检验样品是否存在碳酸钠和亚硫酸钠 |
(3)先用药匙取适量白色粉末于试管中,加入适量H2SO4,将产生的气体通入盛有品红试液的试管中,若品红试液不褪色,澄清石灰水变浑浊,证明混合物中不存在亚硫酸钠,该白色粉末成分为碳酸钠,则假设1成立,
若品红试液褪色,澄清石灰水不变浑浊,证明混合物中存在亚硫酸钠,则假设2成立;
品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊,则假设3成立,
故答案为:
| 假设编号 | 相应现象 |
| 假设一 | 品红和KMnO4溶液均无颜色变化,澄清石灰水变浑浊 |
| 假设二 | KMnO4溶液颜色变浅(或不褪色),澄清石灰水不变浑浊 |
| 假设三 | 品红褪色,KMnO4溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
(4)该实验中,酸性高锰酸钾溶液用于氧化二氧化硫,达到除去二氧化硫的目的,必须满足二氧化碳不能反应;澄清石灰水的作用是检验二氧化碳气体的存在情况,
A.氢氧化钠溶液、氢氧化钡溶液:氢氧化钠溶液能够与二氧化碳反应,不能用氢氧化钠溶液代替酸性高锰酸钾溶液,故A错误;
B.碘淀粉溶液,硅酸钠溶液:碘单质能够氧化二氧化硫,且不与二氧化碳反应,可用碘淀粉溶液代替酸性高锰酸钾溶液;硅酸钠溶液能够与二氧化碳反应硅酸沉淀,可用于检验二氧化碳,故B正确;
C.含酚酞的氨水、紫色石蕊试液:氨水能够与二氧化硫、二氧化碳反应,不能代替酸性高锰酸钾溶液,故C错误;
D.溴水、硝酸钡溶液:硝酸钡溶液不与二氧化碳反应,不能用硝酸钡溶液代替澄清石灰水,故D错误;
故答案为:B;
(5)分液漏斗中的液体滴入圆底烧瓶后,烧瓶中压强增大,导致溶液不能顺利滴入烧瓶,将分液漏斗换成恒压分液漏斗,可避免产生较大压强差,使溶液顺利滴入烧瓶,
故答案为:分液漏斗换成恒压分液漏斗.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握性质实验方案设计与评价的原则,试题充分考查学生学生的分析、理解能力及化学实验能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
7.下列反应中,属于加成反应的是( )
| A. | 乙烯使溴水褪色 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯在空气中燃烧 | |
| D. | 还原性铁粉做催化剂用苯与液溴制溴苯 |
12.化学与生活密切相关,下列不正确的是( )
| A. | 聚乙烯是无毒高分子,用作食品包装袋 | |
| B. | 石油的干馏得到汽油、柴油、煤油 | |
| C. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| D. | 王水是由浓盐酸和浓硝酸按3:1混合 |
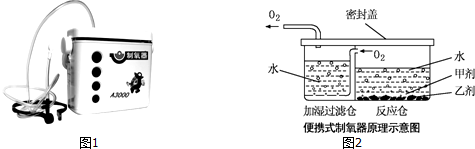
9.小雨对爸爸给患病的奶奶购买的“便携式制氧器”(图1)产生浓厚的兴趣,他仔细阅读使用说明书,了解了它的工作原理(如图2)和所用的药品.药品中甲剂是一种白色颗粒状固体,作制氧剂;乙剂是黑色固体,作催化剂.
【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
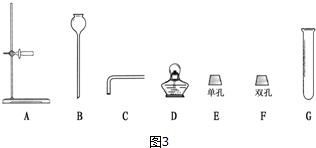
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:ABCFG 或ACEG(填字母),该装置还可用于制取的气体是氢气、二氧化碳;
(2)装置连接完毕,装药品前应先检查装置的气密性;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为2H2O2 $\frac{\underline{\;乙剂\;}}{\;}$2H2O+O2↑;
(4)检验氧气的方法是将带火星的木条伸入集气瓶内,木条复燃.
[实验二]检验上述反应后的溶液中是否含有碳酸根离子.
【实验结论】通过上述实验,小雨得出甲剂是过碳酸钠.
【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是甲剂一定含有钠、碳和氧三种元素(或甲剂可能是过碳酸钠).

【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:ABCFG 或ACEG(填字母),该装置还可用于制取的气体是氢气、二氧化碳;

(2)装置连接完毕,装药品前应先检查装置的气密性;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为2H2O2 $\frac{\underline{\;乙剂\;}}{\;}$2H2O+O2↑;
(4)检验氧气的方法是将带火星的木条伸入集气瓶内,木条复燃.
[实验二]检验上述反应后的溶液中是否含有碳酸根离子.
| 检验步骤 | 实验操作 | 实验现象 | 结论 | |
| 步骤一 | 取少量反应后的溶液,加入稀盐酸 | 有气泡产生 | ||
| 步骤二 | 将步骤一产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是甲剂一定含有钠、碳和氧三种元素(或甲剂可能是过碳酸钠).
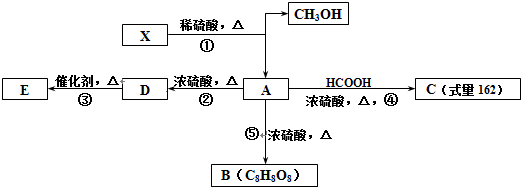
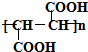
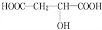 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$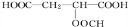 +H2O
+H2O