题目内容
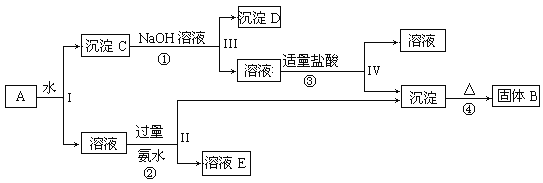
【题目】某实验室废液中含有Fe3+、Fe2+、Cu2+、Ag+四种金属阳离子,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
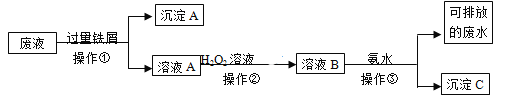
⑴沉淀A的成分是__________________________
⑵操作②中观察到的实验现象是__________________________________________________。
⑶设计一个实验方案,检验可排放的废水中不含Fe3+____________________________________________
【答案】Fe、Cu、Ag 溶液由浅绿色变黄色 取适量可排放废水于试管中,滴加硫氰化钾溶液,若无血红色出现,则不含Fe3+
【解析】
废液中含Fe3+、Fe2+、Cu2+、Ag+四种金属阳离子,操作①中加入过量的铁屑,由于铁的化学性质比铜、银活泼,因此可以把金属铜和银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在操作①得到的滤渣A中都含有金属铜、银和过量的铁,分离固体和溶液需要过滤分离,操作②滤液中加入氧化剂过氧化氢溶液氧化亚铁离子为铁离子,加入强碱溶液后生成氢氧化铁沉淀C,过滤得到可排放废液。
⑴根据以上分析可知,沉淀A的成分是Fe、Cu、Ag;
⑵操作②滤液中加入氧化剂过氧化氢溶液氧化亚铁离子为铁离子,观察到的实验现象是溶液由浅绿色变黄色;
⑶取适量可排放废水于试管中,滴加硫氰化钾溶液,若无血红色出现,则不含Fe3+。

【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水, 易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室 用 下列流程制备:
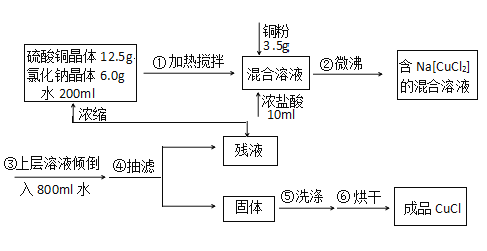
注:Na[CuCl2](易电离,溶液无色)水NaCl+CuCl↓(白色沉淀)。请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式_____________。
(2)判断步骤②反应完全的现象是_______________。
(3)步骤④有关抽滤操作,下列说法正确的是_________。
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是______________。
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是___________________。
(6)氯化亚铜的定量
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解。
②用0.10mol·L-1硫酸锶铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+
三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为____________。(结果保留三位有效数字)
【题目】短周期四种主族元素X、Y、Z、Q在周期表中的位置如图所示。X、Y、W的最外层电子数之和与Q原子核内质子数相等。下列说法中不正确的是( )
X | Y | ||
Z | Q | ||
W |
A. 离子半径![]() :r(Wm-)>r(Qm-)>r(Zn-)
:r(Wm-)>r(Qm-)>r(Zn-)
B. 元素Z和Y的化合价都可能存在![]() 价
价
C. 可以推测HWO4是W的最高价氧化物的水化物
D. X元素的氢化物种类繁多,大多可以与W元素的单质发生反应