题目内容
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
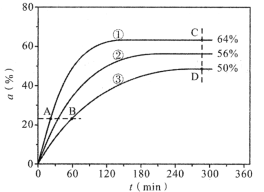
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____;A、B、C、D四点中,v正最大的是___,v逆最大的是____。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
【答案】> 3.2 ① A C 2:1 不变 bc
【解析】
(1)根据图像,①的速率最快,说明①对应的是最高温度348K,温度升高,平衡时转化率增大,说明正向是吸热的,所以ΔH>0;348K时,设初始投入为1mol,则有:

带入平衡常数表达式:Kx=χ(CH3COOC6H13) χ(CH3OH) / [χ(CH3COOCH3) χ(C6H13OH)] = 0.32×0.32 / (0.18×0.18) = 3.2;k正、k逆是温度的函数,根据平衡移动的规律,k正受温度影响更大,因此温度升高,k正增大的程度大于k逆,因此,k正-k逆值最大的曲线是①;根据v正= k正χ(CH3COOCH3)χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)χ(CH3OH),A点χ(CH3COOCH3)χ(C6H13OH)大,温度高,因此A点v正最大;C点χ(CH3COO C6H13)χ(CH3OH)大且温度高,因此C点v逆最大;故答案为:>;3.2;①;A;C;
(2)增大己醇的投入量,可以增大乙酸甲酯转化率,因此,2:1时乙酸甲酯转化率最大;化学平衡常数Kx只与温度有关,因此不变;故答案为:2:1;不变;
(3)催化剂参与了醇解反应,改变了反应历程,a错误;
催化剂不影响化学平衡,说明催化剂使k正和k逆增大相同倍数,b正确;
催化剂能够降低反应的活化能,c正确;
催化剂不改变化学平衡,d错误;
故答案为:bc。