题目内容
【题目】Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
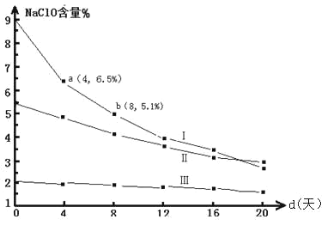
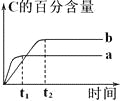
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。
【答案】2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH HClO K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为NaClO更充分,且NaClO比HClO更稳定 ClO-+2e-+H2O=Cl-+2OH- > 在相同条件下,次氯酸钠的浓度越大,其分解速率越大
H2↑+Cl2↑+2NaOH HClO K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为NaClO更充分,且NaClO比HClO更稳定 ClO-+2e-+H2O=Cl-+2OH- > 在相同条件下,次氯酸钠的浓度越大,其分解速率越大
【解析】
电解NaCl溶液的方程式为:2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH;氯水具有漂白性,原因是氯水中含有具有强氧化性的次氯酸;漂白液的有效成分为次氯酸钠,使用时,其与空气中的二氧化碳结合生成次氯酸从而起到漂白的作用;次氯酸不稳定易分解,不便于运输,而把次氯酸转化为次氯酸钠,次氯酸钠稳定,便于运输;根据图象的趋势和数据可知,在相同条件下,次氯酸钠的浓度越大,其分解速率越大。
H2↑+Cl2↑+2NaOH;氯水具有漂白性,原因是氯水中含有具有强氧化性的次氯酸;漂白液的有效成分为次氯酸钠,使用时,其与空气中的二氧化碳结合生成次氯酸从而起到漂白的作用;次氯酸不稳定易分解,不便于运输,而把次氯酸转化为次氯酸钠,次氯酸钠稳定,便于运输;根据图象的趋势和数据可知,在相同条件下,次氯酸钠的浓度越大,其分解速率越大。
(1)电解NaCl溶液可生成氢气、氯气和氢氧化钠,方程式为:2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;
(2)①氯水中含有盐酸和次氯酸,氯气和盐酸都不具有漂白性,具有漂白性的是次氯酸(HClO);
②氯水和漂白液的有效成分分别为HClO、NaClO,根据平衡常数K2>K1,确定漂白液的有效成分更多,并且NaClO比HClO更稳定,所以不直接使用氯水而使用漂白液做消毒剂;
(3)Fe-2e-=Fe2+应为负极反应,则正极反应中ClO-得电子被还原,方程式为:ClO-+2e-+H2O=Cl-+2OH-;
(4)根据漂白液中NaClO 的质量百分含量随时间变化图可知Ⅰ的次氯酸钠的含量大于Ⅱ的,浓度越大反应速率越大,则v(Ⅰ)>v(Ⅱ)。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】下列实验不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定等物质的量浓度的H2CO3、H2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别放入相同浓度的盐酸中 | 比较铁、铜的金属性强弱 |
A.AB.BC.CD.D
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1 mol DAx与足量的A2C反应生成44.8 L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10 min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________(用离子符号表示)。
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式__________;J、L中能使酸性高锰酸钾溶液褪色的是_______(填化学式)。
(4)B2A4C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为________;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
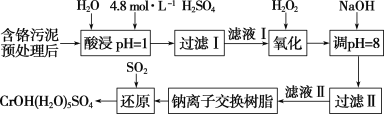
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要______。
(2)酸浸时,为了提高浸取率可采取的措施有________、________。(答出两点)
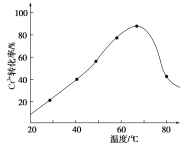
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是_________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)________(填 “是”或“否”)。已知Ksp[Mg(OH)2]=1.8×10-11。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式 _________。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式_____________。