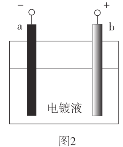
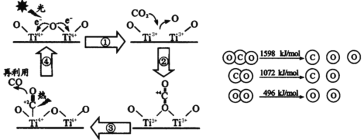
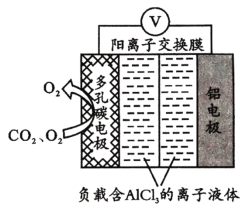
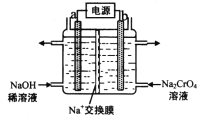
题目内容
【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
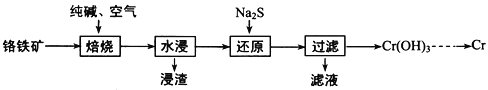
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
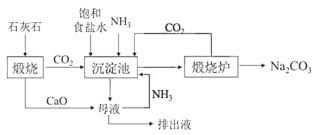
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
【答案】非氧化还原 Na2SO4+4C![]() Na2S+4CO↑ NH3与水反应使溶液显碱性,增大CO2的溶解量和HCO
Na2S+4CO↑ NH3与水反应使溶液显碱性,增大CO2的溶解量和HCO![]() 的浓度 原料利用充分、成本较低、对设备腐蚀小 0~10℃
的浓度 原料利用充分、成本较低、对设备腐蚀小 0~10℃
【解析】
Ⅰ.路布兰法是利用食盐晶体和浓硫酸在高温下反应生成硫酸钠和氯化氢,再利用C与石灰石和硫酸钠高温加热生成碳酸钠;
Ⅱ.索尔维用氨碱法生产碳酸钠,反应原理为利用氨化饱和的NaCl与CO2反应得到NaHCO3,将碳酸氢钠分解即可得到纯碱碳酸钠;
Ⅲ.侯德榜研究出联合制碱法为在饱和的氯化钠溶液中直接通入氨气和CO2,得到氯化铵和碳酸氢钠晶体,并利用碳酸氢钠的分解制得纯碱。
(1)流程Ⅰ利用高沸点酸制挥发性酸原理,氯化钠与浓硫酸混合加热生成硫酸钠和氯化氢,反应中没有化合价变化,属于非氧化还原反应;a步的反应为硫酸钠与碳在1000℃条件下反应生成硫化钠和一氧化碳,反应是化学方程式为Na2SO4+4C![]() Na2S+4CO↑,故答案为:非氧化还原;Na2SO4+4C
Na2S+4CO↑,故答案为:非氧化还原;Na2SO4+4C![]() Na2S+4CO↑;
Na2S+4CO↑;
(2)氨气的溶解度大于二氧化碳,先通入氨气,氨气与水反应使溶液显碱性,能够增大二氧化碳的溶解量,增大碳酸氢根离子的浓度,便于碳酸氢钠晶体析出,故答案为:NH3与水反应使溶液显碱性,增大CO2的溶解量和HCO![]() 的浓度;
的浓度;
(3)与路布兰法相比,氨碱法的优点有原料利用充分、成本较低、对设备腐蚀小,故答案为:原料利用充分、成本较低、对设备腐蚀小;
(4)由题给溶解度可知,0~10℃NH4Cl低温下溶解度比较小,有利于NH4Cl晶体析出,以防止析出其他晶体,故答案为:0~10℃。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D