题目内容
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
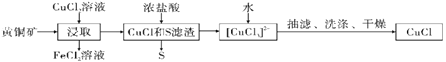
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
【答案】AB
【解析】
黄铜矿和氯化铜反应生成氯化亚铜、氯化亚铁和硫单质,CuCl和盐酸反应生成[CuCl3]2-,加水稀释利用平衡移动原理CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq),平衡逆向移动,生成氯化亚铜。
[CuCl3]2-(aq),平衡逆向移动,生成氯化亚铜。
A. 浸取中的主要反应为CuFeS2+3CuCl2= 4CuCl+FeCl2+2S,参加反应的CuFeS2和CuCl2的物质的量之比为1:3,A项错误;
B. 浸取所得到的FeCl2溶液和铜不反应,B项错误;
C. 加水,反应物浓度减小更多,CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl,C项正确;
[CuCl3]2-(aq)平衡逆向移动,析出CuCl,C项正确;
D. 因CuCl微溶于水,难溶于乙醇,在空气中易被氧化,为提高产率和纯度,因此采用乙醇洗涤、真空干燥CuCl,D项正确;
答案选AB。

练习册系列答案
相关题目